
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные равновесия в растворах сильных электролитов
|
|
|
|
Степень электролитической ионизации (a) равна отношению количества электролита, распавшегося на ионы, к общему количеству растворенного электролита.
По значению a все электролиты принято делить на сильные (a > 0,7), слабые (a < 0,1).
Сильные электролиты диссоциируют практически необратимо, что приводит к увеличению концентрации ионов в растворе и возрастанию межионных взаимодействий. Снижение подвижности ионов уменьшает степень их участия в процессах, протекающих в растворе, создавая эффект уменьшения их концентрации. Количественно влияние межионного взаимодействия на поведение ионов в растворе сильного электролита характеризуется его активностью.
Активность иона (а) – эффективная концентрация иона, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов
а (Х) = g(Х)*с(Х), где
g(Х) – коэффициент активности иона.
В бесконечно разбавленных растворах g(Х)» 1, при увеличении концентрации величина g(Х) уменьшается.
Согласно уравнению Дебая-Хюккеля
lgg = –АZ2 , где
, где
А – константа, зависящая от температуры;
m – ионная сила раствора – величина, характеризующая интенсивность электростатического поля всех ионов в растворе, равная полусумме произведений молярной концентрации каждого иона (сi) на квадрат его заряда (zi)
m = 
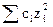
Для разбавленных растворов можно принять А = 0,51, 1 + 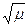 » 1,
» 1,
тогда lgg(X) = –0,51z2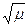
Пример: Определите активность ионов в 0,002М CrCl3.
Решение: CrCl3 ® Cr+3 + 3Cl–
с(Cr+3) = с(CrCl3) = 0,002 моль/л
с(Cl–) = 3с(CrCl3) = 0,006 моль/л
m =  (с(Cr+3)*32 + с(Cl–)*12) =
(с(Cr+3)*32 + с(Cl–)*12) =  (0,002*9 + 0,006*1) = 0,012 моль/л
(0,002*9 + 0,006*1) = 0,012 моль/л
lgg(Cr+3) = –0,51*32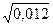 = –0,503
= –0,503
g(Cr+3) = 10–0,503 = 0,31; а (Cr+3) = g*с = 0,31*0,002 = 6,2*10–4 моль/л
lgg(Cl–) = –0,51*12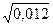 = –0,056
= –0,056
g(Cl–) = 10–0,056 = 0,88; а (Cl–) = g*с = 0,88*0,006 = 5,28*10–3 моль/л
Для разбавленных растворов (m < 0,02) коэффициенты активности можно находить по справочнику, так как согласно правилу ионной силы ионы с одинаковым зарядом независимо от их природы в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 737; Нарушение авторских прав?; Мы поможем в написании вашей работы!