
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водород, галогены и их соединения
|
|
|
|
Химия элементов
229. Даны вещества: СH4–SnH4–NH3–NaH–HBr–B2H6–AlH3–H2S–H2–H2O2–TiH2–H2O–HF. Выберите ряды, соответствующие гидридам и летучим водородным соединениям. Ответ поясните. Напишите реакцию взаимодействия гидридов с водой. Можно ли использовать эту реакцию как способ получения водорода?
230. Составьте уравнения реакций и укажите функции реагентов, укажите в ответе сумму коэффициентов: Н2 + TiO2 =; H2 + Li =; H2 + FeO =;
LiH + H2O =; SiH4 + H2O = SiO2 +; NaH + HCl(разб.) =.
231. Составьте уравнения реакций получения водорода. Укажите в ответе сумму коэффициентов: Ва + Н2О =; Al + H2O =;
Al + H2SO4(разб) = Zn + NaOH(конц) + Н2О =; Mg + HCl =;
Zn + H2SO4(разб) =; Na + H2O =; Al + NaOH + H2O =;
CaH2 + H2O =. Какие это способы получения водорода: лабораторные или промышленные? Какими способами можно получить молекулярный водород в лаборатории и промышлености?
232. Опишите свойства водородосодержащих соединений галогенов
HF–HCl–HBr–HI. Сравните также кислотные свойства галогеноводородов в водном растворе. Объясните возможные различия и предскажите силу кислоты HAt.
233. Сравните свойства галогеноводородов, определяемые химической связью в этих соединениях. Перечислите все функции, которые может выполнять бромоводород в химических реакциях. Укажите какие галогеноводороды получают по реакции: КГ(т) + H2SO4(конц) = … Объясните, почему подобный метод нельзя использовать для получения остальных галогеноводородов и приведите способы их получения.
234. Составьте уравнения следующих реакций с участием хлоридов:
KCl + H2SO4 + PbO2 =; KCl(т) + KHSO4(т) + MnO2(т) =;
HCl(конц) + Са(ClO)2 =; HCl(конц) + PbO2 =. Какие примеси содержат газообразные продукты этих реакций? Как можно освободиться от этих примесей?
235. Составьте уравнения реакций Cl2O, ClO2 и ClO3 с водой, приводящие к получению всех кислородосодержащих кислот хлора. Укажите относительную силу этих кислот в водном растворе. Докажите, что устойчивость кислородных соединений хлора (оксидов и кислот) повышается с увеличением степени окисления хлора.
|
|
|
236. Как изменяются окислительные свойства соединений галогенов с одной и той же степенью окисления при увеличении порядкового номера элемента-галогена? Ответ подтвердите уравнениями соответствующих реакций. Составьте уравнения ОВР:
Cl2 + Ba(OH)2хол = Cl2 + H2O + I2 = HIO3 + …
I2 + 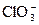 = HI + FeCl3 = FeCl2 + …
= HI + FeCl3 = FeCl2 + …
Br2 + H2S = S ¯ + KClO3 + H2SO4 + KI =
237. Технический продукт, называемый белильной известью имеет состав хСа(ClO)2×уCaCl2×zCa(OH)2×nH2O. Что является «действующим началом» белильной извести как окислителя? Укажите промышленный способ ее получения. Какие свойства Ca(ClO2) обуславливают использование хлорной извести и где?
238. Укажите необходимые условия протекания следующих реакций с участием гипохлорита кальция:
Ca(ClO)2 + CO2 = CaCO3 + Cl2O
Ca(ClO)2 + 2H2O = Ca(OH)2 + 2HClO
Ca(ClO)2 + H2O = Ca(OH)2 + Cl2O
Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2 + 2H2O
Укажите, где используется хлорная известь.
239. Напишите уравнения реакций, характеризующих следующие превращения, и укажите условия их проведения:
SO2 ® Na2SO3 ® NaHSO3 ® Na2SO3 ® Na2SO4
Fe ® FeS ® H2S ® S ® Na2S2O3 ® Na2S4O6
Объясните поведение тиосульфат-иона в сильнокислой и сильнощелочной средах. Объясните это различие.
240. Составьте уравнения полуреакций, доказывающие окислительные и восстановительные свойства пероксида водорода в кислотной и щелочной средах. В какой среде пероксид водорода является: а) более сильным окислителем; б) более сильным восстановителем? Какие свойства преобладают у Н2О2?
241. Данные реакции протекают в водном растворе. Составьте уравнения реакций. Укажите значение рН какого из конечных растворов будет ниже:
2(NH3×H2O) + H2S = 2AlCl3 + 3H2S =
2KOH + H2S = Cr2(SO4)3 + 4H2S =
242. Устойчивость кислородсодержащих соединений брома и иода увеличивается при возрастании степени окисления галогена. Проиллюстрируйте этот вывод уравнениями соответствую-щих реакций.
|
|
|
243. Как изменяются в рядах: HClO ® HClO2 ® HClO3 ® HClO4 и HClO ® HBrO ® HIO кислотные и окислительные свойства? Ответ поясните. Приведите уравнения соответствующих реакций.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1023; Нарушение авторских прав?; Мы поможем в написании вашей работы!