
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры составления условий задач и их решения. Взаимодействие металлов с расплавами щелочей
|
|
|
|
Взаимодействие металлов с расплавами щелочей
Металлы высокой химической стойкости взаимодействуют при сплавлении со щелочами в присутствии окислителей, т.е. в условиях, способствующих образованию и отвечающих их высшей степени окисления анионных оксокомплексов.
Задача 1015. Показать, какие продукты образуются при взаимодействии алюминия с водным раствором едкого натрия:
Al + NaOH + H2O →.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона:
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
(тетрагидроксоалюминат натрия).
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород:
2Al+6H2O=2Al(OH)3+3H2↑.
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OH)3+NaOH=Na[Al(OH)4].
Удвоив последнее уравнение и сложив его с предыдущим, получим суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑.
Задача 1027. Показать, какие продукты образуются при сплавлении металла с окислительно-щелочными смесями:
Mo+KOH+O2 →
Раствор щелочи практически на молибден не действует. Молибден может быть переведен в раствор методом окислительного щелочного сплавления с образованием соответствующего молибдата – молибдата калия.
Mo0+KOH+O2 → K2Mo+6O4 +2H2O
 2 4 Mo+8OH- - 6e = MoO42-+4H2O
2 4 Mo+8OH- - 6e = MoO42-+4H2O
3 6 O2+2H2O+4e = 4OH-
2Mo+16OH-+3O2+6H2O → 2MoO42-+8H2O +12OH-
2Mo+4KOH +3O2 = 2 K2MoO4+2H2O.
В задачах (1008-1033) показать, какие продукты образуются при взаимодействии металлов с водными растворами щелочей: при сплавлении с окислительно-щелочными смесями.
| 1008. 1009. 1010. 1011. 1012. 1013. 1014. 1015. 1016. 1017. 1018. 1019. 1020. 1021. 1022. 1023. 1024. 1025. 1026. 1027. 1028. 1029. 1030. 1031. 1032. 1033. | Be + NaOH + H2O → Al + NaOH + H2O → Na3[Al(OH6)] +…. Ga + NaOH + H2O → Sn + KOH + H2O → K2[Sn(OH)4] +…. Sn + NaOH + H2O → Na2[Sn(OH)6] +…. Pb + KOH + H2O →K2[Pb(OH)4] +…. Pb + NaOH + H2O → Na2[Pb(OH)6] +…. Al + NaOH + H2O → Na[Al(OH4)] +… Zn + NaOH + H2O → Si + KOH + H2O → K2SiO3 +…. Ge + KOH + H2O → K2[Ge(OH)6] + … V + KOH + H2O → KVO3 + H2O Nb + KOH + H2O → Ta + KOH + H2O → V + KOH + O2 → K3[VO4] + H2O Nb + KOH + O2 → Ta + KOH + O2 → W + KOH + O2 → Cr + KOH + O2 → Mo + KOH + O2 → Mo + NaOH + NaNO3 → Na2MoO4 + NaNO2 + H2O Ru + KOH + KClO3 → K2RuO4 +…..+…. Os + KOH + KNO3 → Ru + NaOH + KClO → Na2RuO4 + KCl + H2O Os + NaOH + KClO → Te + KOH(t0, кипячение) → K2TeO3 + K2Te + H2O |
8.3. Окисление металлов ионами Н+ в водных растворах
|
|
|
Металлы, имеющие отрицательное значение стандартного окислительно-восстановительного электродного потенциала, вытесняют водород из кислот (HCl, разбавленной H2SO4, CH3COOH и др.) (см. табл. 4)
Mg + 2HCl = MgCl2 + H2.
Разности потенциалов для реакции между магнием и соляной кислотой при условиях близких к стандартным:
E =  -
- 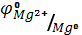 = 0.00 – (-2.34) = 2.34 B.
= 0.00 – (-2.34) = 2.34 B.
Металлы, которые могут иметь различную степень окисления, при взаимодействии с обычными кислотами образуют соли низшей степени окисления:
Fe0 + H2SO4 = Fe+2SO4 + H20.
Образование солей металлов с низшей степенью окисления объясняется сравнительно слабыми окислительными свойствами катионов водорода и более отрицательным значением электродных потенциалов: (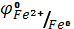 = - 0.44 В) по сравнению с электродным потенциалом (
= - 0.44 В) по сравнению с электродным потенциалом ( = - 0.04 В).
= - 0.04 В).
Некоторые металлы, имеющие отрицательное значение электродного потенциала, не растворяются в кислотах вследствие образования на их поверхности осадка нерастворимой соли (хлорида, сульфата, карбоната, фосфата). Например, свинец практически не растворяется в соляной и разбавленной серной кислоте, т.к. поверхность металла покрывается осадками хлорида и сульфата свинца.
Металлы, имеющие положительные значения, не могут вытеснять водород из кислот и поэтому с ними не взаимодействуют.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1677; Нарушение авторских прав?; Мы поможем в написании вашей работы!