
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аппараты для гематологического анализа
|
|
|
|
Существуют две методики подсчета форменных элементов крови: рутинный с использованием камеры Горяева и автоматизированный с использованием автоматических счетчиков и анализаторов.
Подсчет в счетной камере. В данном случае подсчет форменных элементов крови проводят под микроскопом в строго определенном количестве квадратов камеры Горяева. Затем пересчитывают число форменных элементов на 1 мкл и 1 л крови с учетом объема квадратов и разведения крови.
Для подсчета эритроцитов берут 0,02 мл крови, предварительно разведенной в 200 раз в 4,0 мл изотонического раствора натрия хлорида.
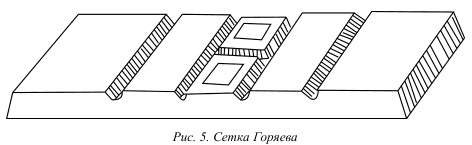
Счетная камера представляет собой толстую стеклянную пластину, с расположенным в центре углублением, равным 0,1 мм. На дне камеры нанесены 2 сетки Горяева, разграниченные поперечной канавкой. Сбоку от сеток расположены стеклянные прямоугольные пластины, к которым притирается шлифованное покровное стекло.
Каждая сетка Горяева состоит из 225 больших квадратов, 25 из которых разделены еще на 16 малых квадратов каждый. Сторона большого квадрата равна 0,2 мм, сторона малого квадрата – 0,05 мм. Соответственно площадь большого квадрата составляет 0,04 мм2, малого квадрата – 0,0025 мм2. Если учитывать глубину камеры, равную 0,1 мм, то объем одного малого квадрата сетки Горяева составит 2,5 х 104 мкл (см. рис. 6).

Рис. 6. Сетка Горяева для подсчета форменных элементов
Перед заполнением кровью счетную камеру и покровное стекло необходимо тщательно протереть и высушить. Большими пальцами покровное стекло плотно прижимают к боковым пластинам камеры и слегка передвигают его вверх и вниз до тех пор, пока не появятся радужные полосы («ньютоновые кольца»). Только при соблюдении этих условий достигается должный объем камеры.
|
|
|
Перед тем как заполнить камеру взвесью крови в изотоническом растворе необходимо содержимое пробирки несколько раз встряхнуть. Пипеткой набирают небольшой объем взвеси крови и выпускают несколько капель на фильтровальную бумагу. После чего переносят каплю разведенной крови на край покровного стекла, следя за тем, чтобы кровь равномерно заполняла всю поверхность камеры с сеткой, не затекая в боковые бороздки. Если это случится, то излишки крови необходимо удалить фильтровальной бумагой.
Подсчет эритроцитов проводят при малом увеличении микроскопа.
Эритроциты подсчитывают в 5 расположенных по диагонали сетки квадратах, которые в свою очередь разделены на малые, то есть подсчет ведется в 80 малых квадратах. Для этого под микроскопом находят верхний левый большой квадрат сетки (разделенный на 16 малых) и начинают подсчитывать число эритроцитов с него. При этом целесообразно придерживаться определенной последовательности подсчета эритроцитов: передвигаться из одного малого квадрата в другой по горизонтали, например один ряд – справа налево, другой ряд – слева направо и т. д., как показано на рисунке.
В каждом малом квадрате подсчитывают эритроциты, находящиеся внутри него, а также расположенные, например, на левой и верхней границах квадрата, пропуская эритроциты, лежащие на нижней и правой границах. Это позволяет добиться того, чтобы клетки, расположенные на границе квадратов, не считались дважды.
Количество эритроцитов в 1 мкл (1 мм3) крови рассчитывают по формуле:
X = a х 200/b х 80,
где Х – число эритроцитов в 1 мкл крови, а – число сосчитанных эритроцитов, Ь – объем малого квадрата (2,5 х 10‑4 мкл), 200 – разведение крови, 80 – число малых квадратов, в которых производился счет.
Если ввести в эту формулу значение объема одного малого квадрата сетки Горяева, можно получить упрощенную формулу подсчета форменных элементов:
|
|
|
Х = а х 200/80 х 2,5 х 10‑4 = а х 200/200 х 10‑4 = а/10‑4 = а х 104.
Количество эритроцитов в 1 мкл (Х) равно числу форменных элементов крови, подсчитанных в 80 малых квадратах, умноженному на 104:
Х= а х 104.
Например, в 5 больших квадратах (80 малых) сосчитано 456 эритроцитов. Тогда количество эритроцитов в 1 мкл составит 4 560 000, или примерно 4,5 х 106/мкл. Учитывая, что в 1 л жидкости содержится 106 мкл, число подсчитанных эритроцитов можно выразить следующим образом: 4,5 х 1012/л. Это последнее обозначение числа форменных элементов является в последние годы общепринятым.
Подсчет количества лейкоцитов в счетной камере проводят аналогичным образом. Однако каплю крови (0,02 мл) разводят в 20 раз 3–5%‑ным раствором уксусной кислоты (0,4 мл), гемоли‑зирующей эритроциты. Затем разведенной взвесью клеток заполняют счетную камеру Горяева, как описано выше. Заполненную камеру оставляют на 1 мин для оседания лейкоцитов, после этого устанавливают ее на столик микроскопа и при малом увеличении подсчитывают лейкоциты в 100 больших квадратах сетки Го‑ряева, не разделенных на малые квадраты и полосы. Так же как и при подсчете эритроцитов, считают клетки, расположенные внутри квадрата и на его левой и верхней границах.
Расчет общего количества лейкоцитов проводят по формуле:
Х = а х 20/100 х Ь,
где Х – число лейкоцитов в 1 мкл крови;
а – число посчитанных лейкоцитов;
Ь – объем одного большого квадрата (4,0 х 10‑3 мкл);
20 – разведение крови;
100 – число больших квадратов, в которых производился счет.
Введя в эту формулу значения объема одного большого квадрата, получим:
X = а х 20/100 х (4 х 10‑3) = а х 20/400 х 10‑3 = а х 50/мкл.
Таким образом, количество лейкоцитов в 1 мкл равно числу клеток, посчитанных в 100 больших квадратах, умноженному на
50:
X = а х 50.
Пример: в 100 больших квадратах сосчитано 130 лейкоцитов. Тогда количество лейкоцитов в 1 мкл составит (130 х 50) = 6500, или 6,5 х 103/мкл. Учитывая, что в 1 мкл крови содержится 106 мкл, число посчитанных лейкоцитов можно выразить следующим образом: 6,5 х 109/л.
Поскольку подсчет количества форменных элементов в камере Горяева представляет собой весьма трудоемкое исследование, в клинической практике все чаще используют специальные автоматические счетчики клеток крови и гематологические автоматы, работа которых основана на разных принципах.
|
|
|
По механизму работы они все делятся на две большие группы: кондуктометрические, оптические с использованием в качестве источников света лазеров (проточные цитометры).
В основе работы кондуктометрических анализаторов лежит изменение электрического сопротивления. Определенное количество разведенной изотоническим раствором натрия хлорида или другим электролитом крови пропускают через микроотверстие. Проходящая клетка увеличивает сопротивление между электродами, возникающий импульс передается на счетное устройство с цифровой индикацией. Данная методика была предложена братьями Культер в 1947 г.
Однако если в один момент в канале находятся две клетки, то будет зарегистрирован только один импульс, что приведет к ошибке подсчета клеток. Во избежание таких ошибок, нужно развести пробу крови до такой концентрации клеток, при которой в канале датчика всегда будет не больше одной клетки.
Чтобы определить необходимую степень разведения цельной крови, нужно знать объем измерительного канала (V канала). Если в объеме измерительного канала в среднем находится одна клетка, то концентрация равна канала. Однако при этом вероятность того, что в канале могут находиться две и более клеток, достаточно велика. По законам математической статистики вероятность одновременного прохождения двух клеток через канал ничтожно мала, если концентрация клеток в 10 раз меньше, чем канала. При диаметре канала 80 мкм и длине 100 мкм получаем объем 0,5 мм3. Чтобы уменьшить концентрацию клеток цельной крови (5 000/мм3) до нужной величины, необходимо выполнить разведение в 5 000 х 0,5 х 10 = 25 000 раз.
Раздельное определение эритроцитов и тромбоцитов в современных анализаторах решается просто: тромбоциты (небольшие по размеру клетки) при прохождении измерительного канала генерируют электрические импульсы низкой амплитуды, а клетки большего размера – эритроциты – импульсы высокой амплитуды. Устройство, которое разделяет импульсы по величине амплитуды, – дискриминатор. В современных анализаторах применяются многоканальные дискриминаторы, позволяющие получить детальную информацию о размерах клеток в виде гистограмм, поскольку каждый канал соответствует определенному объему клеток. Выделив на гистограмме зону объемов клеток, соответствующих эритроцитам, и просуммировав данные, полученные по всем каналам, можно получить общее количество прошедших через датчик эритроцитов. Если при суммировании результатов подсчета эритроцитов значение каждого канала умножать на величину объема соответствующего канала, то получится величина суммарного объема, который занимают эритроциты – гематокрит. При делении гематокрита на концентрацию эритроцитов можно получить еще одну характеристику эритроцитов – средний объем.
|
|
|
Аналогичные показатели можно получить и для тромбоцитов: концентрацию тромбоцитов, тромбокрит, средний объем тромбоцитов.
Поскольку размеры лейкоцитов близки к размерам эритроцитов, их не удается разделить вышеописанным методом. При использовании кондуктометрических счетчиков в подсчет эритроцитов неизбежно будут вносить вклад лейкоциты. Однако за исключением явных лейкоцитозов их вклад будет ничтожно мал, так как в норме концентрация эритроцитов в крови на 3 порядка превышает концентрацию лейкоцитов. В то же время при определении концентрации лейкоцитов необходимость разрушения эритроцитов очевидна. Эта задача оказалась легко решаемой, так как свойства мембран эритроцитов и лейкоцитов существенно различаются. В частности, эритроциты легко лизируются под воздействием многих поверхностно‑активных веществ, при этом лейкоциты, хотя и претерпевают некоторые изменения, но остаются целыми. Таким образом, при подсчете лейкоцитов, прежде чем пропустить разведенную суспензию крови через апертуру датчика, к ней добавляют раствор поверхностно‑активного соединения (лизирующий раствор или гемолитик). Под действием гемолити‑ка эритроциты разрушаются до очень мелких осколков, которые при подсчете лейкоцитов генерируют электрические импульсы очень низкой амплитуды, не влияющие на результат анализа.
Для гематологических анализаторов с дифференциацией лейкоцитарной тройки используется специальная композиция растворителя и гемолитика, в которой различные формы лейкоцитов претерпевают изменения размеров в разной степени и благодаря этому могут разделяться кондуктометрическим методом. Область малых объемов формируется лимфоцитами, которые под действием гемолитика значительно уменьшаются в объеме. Грануло‑циты, напротив, расположены в области больших объемов. Между двумя пиками расположена зона так называемых «средних лейкоцитов», в которую попадают моноциты, базофилы, эозино‑филы и плазматические клетки (см. рис. 7).

Все современные гематологические автоанализаторы измеряют и концентрацию гемоглобина, для чего у них имеется встроенный гемоглобинометр. При этом измерение концентрации гемоглобина происходит параллельно с определением концентрации лейкоцитов.
Оптические гематологические анализаторы в своей работе используют эффекты светорассеяния и флуоресценции, часто такие устройства называют проточными цитометрами. Измерение светорассеяния на клетках крови в проточных цитометрах производится в определенные телесные углы: 5°, 10°, 90°. Таким же образом измеряется деполяризация светорассеяния от клеток в 90°. Сочетание упомянутых сигналов светорассеяния применяется для дифференцировки лимфоцитов, моноцитов, нейтрофилов, базо‑филов, эозинофилов. Рассеяние в телесные углы 5° и 10° используют для измерения объема и концентрации гемоглобина эритроцитов. В измерительной камере устройства молекулы некоторых клеточных структур, пересекая луч монохромного лазера, поглощают свет определенной длины волны и переходят в возбужденное состояние. Через короткое время клетки возвращаются в исходное состояние, но при этом испускают кванты света с иными длинами волн. Это вторичное излучение, имеющее строго определенные для каждого вида клеток или их структур длины волн, проходит через оптическую систему прибора и регистрируется фотоэлектронным умножителем, который преобразует его в электрические сигналы, которые затем обрабатываются с помощью компьютера.
Физические свойства клеток (размер или цитоплазматическая гранулярность) могут быть измерены на любой отдельной неокрашенной клетке. Клетки также могут быть помечены специфическими красителями, окрашивающими ДНК, РНК или белок, или целым набором флюорохром‑конъюгированных антител, направленных к мембранным и внутриклеточным компонентам клеток.
Метод проточной цитометрии позволяет существенно увеличить объем информации, снимаемой с анализируемой частицы по светорассеянию. Только с использованием этой методики можно измерить индикатрису светорассеяния индивидуальной частицы. Индикатриса светорассеяния – это зависимость интенсивности рассеянного света от угла рассеяния. Причем диапазон измеряемых углов в проточных цитометрах составляет 5‑120°. Технология проточной цитометрии включает в себя не только измерения индикатрисы светорассеяния, но и методы решения обратной задачи светорассеяния, т. е. методы, позволяющие получать информацию о морфологии клетки из индикатрисы светорассеяния. Таким образом, измерение и обработка индикатрис светорассеяния от клеток позволяют не только дифференцировать клетки крови, но и характеризовать эти клетки: определять их размер, форму, структуру, состав и т. д.
Технология проточной цитометрии имеет ряд преимуществ перед описанными выше методиками.
1. Если изображение в микроскопе является двумерной проекцией клетки, то индикатриса светорассеяния является своего рода одномерным отображением клетки и содержит не меньше информации о характеристиках клетки. В случае каких‑либо патологических явлений в клетке можно создавать банк данных индикатрис светорассеяния патологических клеток, точно так же как это уже сделано для микроскопных изображений, и не прибегая к микроскопу в реальном времени производить анализ.
2. Благодаря развиваемым подходам в решении обратной задачи светорассеяния контроль качества работы прибора может осуществляться ежедневным измерением калибровочных сфер определенного размера, а не по крови здорового донора и контрольных измерений калибровочной крови.
3. Использование большого количества информации, содержащейся в индикатрисе светорассеяния, повышает способность проточных цитометров к дифференцировке клеток крови по сравнению с другими гематологическими анализаторами. Благодаря этому в анализах можно исключить использование некоторых химических реагентов.
4. Кинетические измерения индикатрис светорассеяния клеток в процессе реагирования на какое‑либо воздействие в сочетании с развиваемой кинетической моделью данного процесса позволяют определять многие дополнительные характеристики клеток. Так, при измерении процесса лизиса и сферизации эритроцитов можно измерить их дополнительные характеристики, такие как площадь, проницаемость и жесткость мембраны.
В настоящее время все проточные цитометры по производительности можно разделить на две группы:
1) простые в использовании и обслуживании аппараты, которые могут измерять флуоресценцию при двух и более длинах волн и светорассеяние под углом около 10° (малоугольное прямое рассеяние) и 90°;
2) большие клеточные анализаторы, которые не только измеряют пять и более клеточных или ядерных параметров, но и сортируют частицы с заданным набором этих параметров.
Сегодня проточная цитометрия – ведущий метод в клинической иммунологии. В клинической гематологии он может быть использован для решения следующих задач:
1) иммунофенотипирования лимфоцитов, включая определение количества СD4, СD8 клеток и даже ТН1 и ТН2 (по продукции специфических цитокинов);
2) анализа процессов клеточной активации на основе определения маркеров ранней активации: СБ25 (рецептор интерлейки‑на‑2), СD38, СD69, СD71 (трансферриновый рецептор), СD95 (антиген апоптоза), СD122, анти‑HLA‑DR;
3) определения маркеров пролиферативной активности клеток иммунной системы (Ki‑67, PCNA, Cyclin D3);
4) оценки внутриклеточной продукции цитокинов различными клеточными популяциями;
5) иммунофенотипирования острых лейкозов и лимфом;
6) анализа клеточного цикла с определением распределения клеточной популяции по фазам цикла (ДНК‑цитометрия);
7) детекции и наблюдения минимальной резидуальной болезни (МRD);
8) анализа маркеров апоптоза (аннексина V, CD95 Fas/APO‑1, CD95L, Bcl‑2, P53).
В качестве примера устройств, использующих в своей работе методику проточной цитометрии, может послужить проточный цитометр EPICS 4 XL фирмы Beckman Coulter (США).
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1629; Нарушение авторских прав?; Мы поможем в написании вашей работы!