
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент
|
|
|
|
Гальванический элемент - химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить.
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью.
ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:
U = Eэ – I(r1–r2) – ΔE,
где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с уменьшением концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах (вспомним уравнение Нернста). Однако чем медленнее снижается напряжение при разряде гальванического элемента, тем больше возможностей его применения на практике. Емкостью элемента называют общее количество электричества Q, которое гальванический элемент способен отдать в процессе работы (при разрядке). Емкость определяется массой запасенных в гальваническом элементе реагентов и степенью их превращения. При увеличении тока разряда и снижении температуры работы элемента, особенно ниже 00С, степень превращения реагентов и емкость элемента снижаются.
|
|
|
Энергия гальванического элемента равна произведению его емкости на напряжение: ΔН = Q.U. Наибольшей энергией обладают элементы с большим значением ЭДС, малой массой и высокой степенью превращения реагентов.
Сохраняемостью называют продолжительность срока хранения элемента, в течение которого его характеристики остаются в заданных параметрах. С ростом температуры хранения и эксплуатации элемента, его сохраняемость уменьшается.
Состав гальванического элемента: восстановителями (анодами) в портативных гальванических элементах, как правило, служат цинк Zn, литий Li, магний Mg; окислителями (катодами) – оксиды марганца MnO2, меди CuO, серебра Ag2O, серы SO2, а также соли CuCl2, PbCl2, FeS и кислород О2.
Самым массовым в мире остается производство марганец–цинковых элементов Mn–Zn, широко применяемых для питания радиоаппаратуры, аппаратов связи, магнитофонов, карманных фонариков и т.п. Конструкция такого гальванического элемента представлена на рисунке
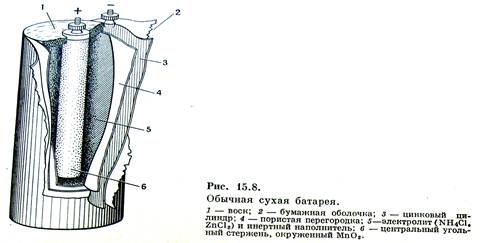
Токообразующими реакциями в этом элементе являются:
- на аноде (–): Zn – 2ē → Zn2+ (на практике происходит постепенное растворение цинковой оболочки корпуса элемента);
- на катоде (+): 2MnO2 + 2NH4+ + 2ē → Mn2O3 + 2NH3 + H2O.
|
|
|
В электролитическом пространстве также идут процессы:
- у анода Zn2+ + 2NH3 →[Zn(NH3)2]2+;
- у катода Mn2O3 + H2O → [Mn2O2(OH)2] или 2[MnOOH].
В молекулярном виде химическую сторону работы гальванического элемента можно представить суммарной реакцией:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + 2[MnOOH].
Схема гальванического элемента:
(–) Zn|Zn(NH3)2]2+||[MnOOH]|MnO2 (С) (+).
ЭДС такой системы составляет Е= 1,25 ÷ 1,50В.
Гальванические элементы с подобным составом реагентов в щелочном электролите (КОН) имеют лучшие выходные характеристики, но они неприменимы в портативных устройствах в силу экологической опасности. Еще более выгодными характеристиками обладают серебряно-цинковые элементы Ag-Zn, но они чрезвычайно дороги, а значит, экономически неэффективны. В настоящее время известно более 40 различных типов портативных гальванических элементов, называемых в быту «сухими батарейками».
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1789; Нарушение авторских прав?; Мы поможем в написании вашей работы!