
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Величина коэффициента активности указывает на степень отклонения реальных растворов от идеальности
|
|
|
|
Если пар подчиняется законам идеальных газов, то

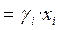 , (19)
, (19)
где 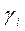 - коэффициент активности.
- коэффициент активности.
Для реальных растворов могут наблюдаться как положительные, так и отрицательные отклонения от закона Рауля (рис. 7), что связано с различиями в силах межмолекулярного взаимодействия между однородными и разнородными молекулами компонентов раствора.

Рис. 7. Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля.
Понижение температуры замерзания и повышение температуры кипения разбавленных растворов.
Раствор в отличие от чистой жидкости не затвердевает полностью при постоянной температуре - при некоторой температуре (температура начала кристаллизации) начинают выделяться первые кристаллы твердой фазы и по мере кристаллизации температура раствора понижается. Если эти кристаллы состоят только из растворителя, то температура замерзания раствора (Тзам) всегда ниже температуры замерзания чистого растворителя (Тпл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора (ΔТзам)
ΔТзам = Тпл - Тзам (20)
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
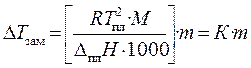 (21)
(21)
где М — молекулярная масса растворителя;
Dп л Н — энтальпия плавления растворителя;
m — моляльность раствора;
K – криоскопическая постоянная, зависящая от свойств только растворителя, и численно равная понижению температуры замерзания одномоляльного раствора. Для воды К = 1,86.
Диссоциация растворенного вещества приводит к увеличению числа частиц (ионов). Поэтому для растворов электролитов
|
|
|
 (22)
(22)
где i – изотонический коэффициент Вант-Гоффа, показывающий во сколько раз увеличилось число частиц в растворе вследствие диссоциации.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 668; Нарушение авторских прав?; Мы поможем в написании вашей работы!