
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения
Пример
Cl Cl
С гибридизацией АО
| Тип гибридизации | Структура молекулы | Валентный угол |
| sp |  линейная линейная
| 180о |
| sp2 | 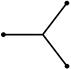 плоский треугольник плоский треугольник
| 120о |
| sp3 | 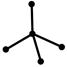 тетраэдр тетраэдр
| 109,3о |
4.1 sp- гибридизация (2А подгруппа или d-элемент)
Молекула ВеСl2
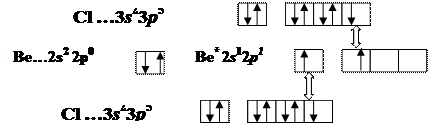
Cl Be Cl
sp -гибридизация АО Ве, валентный угол Ð180о
пространственная структура линейная,
связь полярная m св ¹ 0, т.к. ЭО(Ве) = 1,5, ЭО(Cl)= 3,0 и ∆ЭО≠0
m мол = S m св = 0 молекула в целом неполярная Cl Be ® Cl
4.2. sp2- гибридизация (3А подгруппа )
 Молекула ВН3
Молекула ВН3

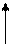
 В* 2 s1 2 p2
В* 2 s1 2 p2
 |
H 1 s H 1 s H 1 s
sp 2–гибридизация АО В, 3 s - связи, Ð 120°, связи полярные DЭО=(2.1-2.0)¹0, m св ¹ 0. Структура молекулы - плоский треугольник. m мол = S m св = 0 молекула ВН3 – неполярная.
 Аналогично для BCl3, но BFCl2 – полярная молекула
Аналогично для BCl3, но BFCl2 – полярная молекула
F
 m мол
m мол

 BFCl2
BFCl2
4.3. sp3 -гибридизация (4А подгруппа)
Молекула SnCl4
 Si * 5 s 5 pCl 3 s 3 p
Si * 5 s 5 pCl 3 s 3 p
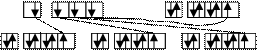 |
 ClCl Cl
ClCl Cl
sp 3- гибридизация АО Sn m св
структура молекулы - тетраэдр, Ð 109,30

 связи полярные DЭО = (3.0-1.8) ¹ 0, m св ¹ 0
связи полярные DЭО = (3.0-1.8) ¹ 0, m св ¹ 0
S m св= 0 - молекула в целом неполярная
Аналогично для СCl4но СFCl3 – полярная молекула
4.4. В гибридизации участвуют не только АО связывающих электронов, но и АО неподеленных электронных пар (НП)
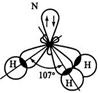
Молекулы NН3 Н2О

 N …2 s 22 p 3 O …2 s 22 p 4
N …2 s 22 p 3 O …2 s 22 p 4

H 1 s 1 H 1 s 1 H 1 s 1 Н 1 s 1 Н 1 s 1
Валентные углы для NH3 107,3º и Н2О 104,5º (близки к тетраэдрическому 109,3º). Это позволяет предположить sp3–гибридизацию АО N в молекуле NН3 и О в молекуле Н2О. Неподеленные электронные пары (НП) влияют на величину валентных углов, силы отталкивания между ними больше, чем между относительно закрепленными связывающими электронными парами (СП).
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о, а в молекуле Н2О две НП уменьшают его до 104,5о.
Элементы-аналоги - элементы, имеющие одинаковое строение внешних электронных оболочек (аналогичную валентную формулу) и расположенные в одной подгруппе. Они обладают сходными свойствами.
Параметры химической связи: энергия Есв, длина lсв, кратность, валентные углы
Есв – количество энергии, выделяющейся при образовании химической связи (кДж/моль). Чем ↑ Есв , тем устойчивее молекула
lсв - расстояние (в нм) между ядрами химически связанных атомов в соединении (зависит от размеров электронных оболочек и степени их перекрывания). Чем ↓ lсв, тем ↑ Есв и устойчивее молекула
Кратность связи - количество связей между взаимодействующими атомами.
Чем ↑ кратность связи, тем ↑ Есв и устойчивее молекула.
Валентный угол - угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов.
В молекуле MgCl2 большую валентность проявляет Mg (B*=2) – элемент 2А подгруппы, общая электронная формула ns2, электронные аналоги:
Be… 2s2, Ca… 4s2, Sr… 5s2, Ba… 6s2, Ra… 7s2.
ЭО(Be) = 1,5 ЭО(Mg) =1,2 ЭО(Ca) = 1,0 ЭО(Sr) = 1,0 ЭО(Ba) = 0,9 ЭО(Ra) = 0,9 ЭО(Cl) = 3,0
Однотипные молекулы: BeCl2 MgCl2 CaCl2 SrCl2 BaCl2 RaCl2
∆ЭО 1,5 1,8 2,0 2,0 2,1 2,1
-----------------------------------------------------------------→
Рост lсв, уменьшение Есв и устойчивости молекула,
Рост ∆ЭО и µсв (полярности связей).
Валентный угол и полярность молекул не изменяется: sp-гибридизация АО центральных атомов - Be, Mg, Ca, Sr, Ba, Ra, валентный угол 1800, структуры молекул – линейные, молекулы неполярные (µм=∑ µсв= 0).
(донорно-акцепторный механизм образования ковалентной связи)
Комплексные соединения - сложные соединения, содержащие комплекс, между частицами которого осуществляется ковалентная связь по донорно-акцепторному механизму
K[BF4] – тетрафтороборат калия K[BF4] → K + + [BF4]-
K + - внешняя сфера
[BF4]- - внутренняя сфера (комплекс) - в квадратных скобках.
Состав комплекса:
· Комплексообразователь (в основном, катион металла) - акцептор
· Лиганды (анионы или молекулы) - доноры
Координационное число (к.ч.) – количество лигандов, координируемых комплексообразователем
Между внешней и внутренней сферой – электростатическое ион-ионное взаимодействие
Между комплексообразователем и лигандами – ковалентная связь по донорно-акцепторному механизму: донор – лиганд (поставщик пары электронов), акцептор – комплексообразователь (наличие свободных АО)
Природу связей в КС объясняют методами ВС, МО, теории кристаллического поля.
Все вакантные орбитали комплексообразователя, принимающие участие в образовании связи, одинаковы по энергии и по форме т.е. они гибридизованы.
Тип гибридизации и структура комплексов
| К.ч. | Гибридизация орбиталей | Структура комплекса |
| sp | линейная | |
| d3s, d2sp, sp3 | тетраэдр | |
| dsp2 | плоский квадрат | |
| d2sp3, sp3d2, dsp3d | октаэдр | |
| sp2 | плоский треугольник | |
| dsp3 | тригональная бипирамида |
· Лиганд сильного поля (электроны на d-подуровне комплексообразователя максимально спариваются)
· Лиганд слабого поля (спаривания электронов на d-подуровне комплексообразователя не происходит)
Для 4d-и 5d-элементов – все лиганды сильного поля. Для 3d-элементов - спектрохимический ряд лигандов: I-<Br-<Cl-<ОН-<F-<H2O<NCS-<NH3< NO2-<CN-<CO (в порядке возрастания силы поля) Но границы между сильным и слабым полями лигандов провести сложно.
Под воздействием поля лигандов происходит расщепление d-подуровня (на величину D, называемую энергией расщепления): d-АО с меньшей и d-АО с большей энергией. D - зависит от к.ч., природы лигандов и комплексообразователя (Dрастет с увеличением силы лиганда и к.ч.)
плоский квадрат
 октаэдр
октаэдр
Е тетраэдр
de dg
Dтетр Dокт Dпл.квадр.
dg
d -орбитали de
свободного иона
комплексообразователя
d-орбитали d-орбитали
в поле лигандав поле лиганда
Магнитные свойства КС
Парамагнитное вещество – втягивается в магнитное поле. Парамагнетизм обусловлен наличием неспаренных электронов (наличие собственного магнитного момента)
Диамагнитное вещество – выталкивается из магнитного поля (из-за отсутствия неспаренных электронов).
Пример 1
K3[CoF6] – гексафторокобальтат калия
[CoF6]3- - комплекс
Co3+ - комплексообразователь Co3+ …3d64s0
F - - лиганд слабого поля F -…2s22p6
КЧ = 6, т.е. имеет место октаэдрическое расщепление.
Энергетическая диаграмма:
F-: F-: F-: F-: F-: F-:














 Е
Е

3dg 4s 4p 4d

 |



 3de
3de
sp3d2 – гибридизация – октаэдр.
внешнеорбитальный, высокоспиновый, парамагнетик
Пример 2
[Co(NH3)6] Cl3 – хлорид гексаамминкобальта
[Co(NH3)6] 3+ - комплекс
Co3+ - комплексообразователь Co3+ …3d64s0
NH3 - лиганд сильного поля (т.к. к.ч.= 6)
КЧ = 6, т.е. имеет место октаэдрическое расщепление
Энергетическая диаграмма
Е:NH3 :NH3 :NH3: NH3:NH3:NH3

3dg 4s 4p
3d 3de
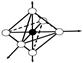
d2sp3-гибридизация– октаэдр;
внутриорбитальный, низкоспиновый (более прочный), диамагнетик.
Пример 3
[Au(NH3)4]Сl3 хлорид тетраамминзолота
[Au(NH3)4]3+ - внутр. сфера ((комплекс)
Сl- - внешняя сфера
Комплексообразователь Au3+:… 5d86s0.
К.ч. = 4, NH3 - лиганд сильного поля, т.к. для 5d- элемента (Au) все лиганды сильного поля, неподеленная пара электронов у атома азота:NH3, dsp2-гибридизация
Энергетическая диаграмма:
|
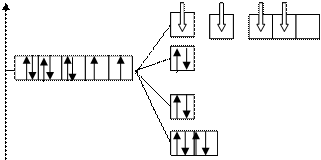 Е
Е
5d
6s 6p
dsp2-гибридизация, структура –
плоский квадрат
низкоспиновый, внутриорбитальный, диамагнетик, устойчивый
|
|
Дата добавления: 2014-11-18; Просмотров: 3110; Нарушение авторских прав?; Мы поможем в написании вашей работы!
