
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение отношения теплоемкостей газа при постоянном давлении и при постоянном объеме
Лабораторная работа 8
Цель работы: измерение показателя адиабаты - отношения теплоемкости при постоянном давлении к теплоемкости при постоянном объеме.
| Оборудование: | |||
| · сосуд с герметической пробкой · соединительные трубки · датчик давления | · клапан · насос ручной · измерительный блок L-микро | ||
При изменении объема газа без теплообмена с окружающей средой (адиабатический процесс) давление p и объем v связаны уравнением адиабаты:
 , (1)
, (1)
где g= Cp /CV - отношение теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме. параметр g является существенной характеристикой газа.
В лабораторной работе для определения показателя адиабаты используется метод Клемана-Дезорма.
Идея метода состоит в том, что находящийся в сосуде газ заставляют совершать изопроцессы, в том числе адиабатический, измеряют давления газа в начале и в конце каждого процесса и по соотношению давлений определяют показатель адиабаты. Из всего газа, заполняющего сосуд, выделяют условно небольшую часть массы m, занимающую объем V. предполагается, что все процессы (сжатие, расширение, нагревание или охлаждение) происходят именно с этой частью газа.
Предположим, что при помощи насоса в сосуд закачено некоторое количество воздуха. При этом давление поднялось до уровня P1. Если накачка производилась медленно или после накачки сделана выдержка порядка 1 минуты, то температура газа сравняется с температурой окружающей среды T0. Рассматриваемая нами порция газа массой m займет объем V1, т.е. будет сжата остальной частью газа. Таким образом, исходное состояние этой порции газа характеризуется параметрами состояния p1, V1, T0 (давление, объем, температура). На pV -диаграмме (рис.1) это состояние 1.
 Рис 1
Рис 1
|
Если теперь быстро выпустить часть газа из сосуда и снова закрыть его, то давление в сосуде (и в выделенной порции газа) упадет до уровня p2. Рассматриваемая нами порция газа расширяется и занимает теперь объем V2. Само количество газа в этой порции остается неизменным, т.к. предполагается, что из сосуда вытекают другие части газа. Расширение - адиабатическое, т.к. вытекание газа из сосуда происходит в течение короткого времени. Поэтому кривая 1-2 на pV -диаграмме - это адиабата. температура здесь будет ниже начальной температуры Т0, т.к. при адиабатическом расширении газ охлаждается. с течением времени температура будет постепенно повышаться до Т0, давление также будет возрастать поскольку сосуд герметичен. Это изохорический процесс (2-3 на диаграмме) при постоянном объеме V2. После выравнивания температуры давление станет равным p3 и перестанет меняться.
Таким образом, состояние порции газа m будет характеризоваться следующими параметрами: давление p3, объем V 2 и температура Т0. В это состояние газ приведен двумя процессами - адиабатическим (кривая 1-2) и изохорическим (отрезок 2-3). Температура в точках 1 и 3 равна Т0, значит переход 1-3 можно было совершить одним изотермическим процессом (соответствующая кривая показана пунктиром).
Теперь запишем соотношения между параметрами газа в точках 1, 2 и 3. Процесс перехода из 1 в 2 - адиабатический, поэтому должно выполняться равенство
p1V1g=p2V2g (2)
Точки 1 и 3 лежат на одной изотерме, поэтому по закону Бойля-Мариотта справедливо:
p1V1=p3V2 (3)
Возведем равенство (3) в степень g и поделим почленно результат возведения на равенство (2). В результате получим:

Здесь объемы в левой и правой частях сокращаются, поэтому имеем:
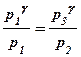 (4)
(4)
Преобразуем (4) к виду:
 или
или 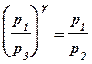 (5)
(5)
Прологарифмируем равенство (5) (в левой части показатель степени g выйдет за знак логарифма):
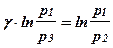
Откуда найдем показатель адиабаты:
 (6)
(6)
Эта формула является расчетной.
|
|
Дата добавления: 2014-11-18; Просмотров: 597; Нарушение авторских прав?; Мы поможем в написании вашей работы!