
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 3. Получение и кислотно-основные свойства гидроксида железа (III)
|
|
|
|
Опыт 2. Восстановительные свойства железа (II)
Опыт 1. Получение и кислотно-основные свойства гидроксида железа (II)
В две пробирки внести по 2 капли раствора сульфата железа (II) (соли Мора) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида железа (II) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия:
– охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида железа (II) в молекулярной и ионной форме
FeSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид железа (II)………….
- составить уравнение реакции гидроксида железа (II) с соляной кислотой в молекулярной и ионной форме
Fe(OH)2 + HCl → …
- отметить, как изменяется внешний вид осадка Fe(OH)2 во второй пробирке при хранении на воздухе, объяснить……………
- составить уравнение реакции окисления гидроксида железа (II) на воздухе
Fe(OH)2 + O2 + … → …
- сделать вывод о свойствах гидроксида железа (II).
а) В пробирку внести по 2 капли раствора сульфата железа (II) (соли Мора) и 2 н раствора гидроксида натрия до образования осадка. Добавить 2-3 капли 3%-ного раствора перекиси водорода (Н2О2).
- Отметить, изменение цвета осадка …..
- Написать уравнение реакции окисления гидроксида железа (II) перекисью водорода до гидроксида железа (III).
Fe(OH)2 + Н2О2 ®
- Указать окислитель…………., восстановитель…………………..;
- Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях…
- Вывод
б) Внести в пробирку 3 капли раствора перманганата калия (KMnO4), 2 капли 2н раствора серной кислоты и несколько кристалликов соли Мора.
|
|
|
- Отметить, какие изменения происходят в пробирке
- Восстановителем в данной реакции является………….., окислителем - ………..
- Составить уравнение реакции:
KMnO4 + H2SO4 + FeSO4 ® MnSO4 + K2SO4 + H2O +.....
- Вывод
В две пробирки внести по 2 капли раствора хлорида железа (III) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида железа (III) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток концентрированного раствора гидроксида натрия:
- охарактеризовать внешний вид осадка
- составить уравнение реакции образования гидроксида железа (III) в молекулярной и ионной форме:
FeCl3 + NaOH → …
- отметить, в избытке какого раствора - соляной кислоты или гидроксида натрия - осадок гидроксида железа (III) растворился полностью
- составить уравнение реакции взаимодействия гидроксида железа (III) с соляной кислотой в молекулярной и ионной форме:
Fe(OH)3 + HCl → …
- частично растворяясь в избытке концентрированного раствора гидроксида натрия, гидроксид железа (III) образует гидроксокомплекс, составить уравнение, отметить в каком направлении смещено это равновесие:
Fe(OH)3 + NaOH 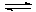 …
…
- отметить, какие свойства - кислотные или основные - преобладают у гидроксида железа (III)……..
- сравнить кислотно-основные свойства гидроксида железа (II) и гидроксида железа (III)………
- Вывод
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 3528; Нарушение авторских прав?; Мы поможем в написании вашей работы!