
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинаміка реакцій горіння твердого вуглецю
|
|
|
|
На реакції взаємодії твердого вуглецю з киснем і окислювальними газами ґрунтується горіння будь-якого твердого палива. Перш ніж розглядати взаємодію вуглецю з киснем, необхідно обговорити процеси окислення вуглецю діоксидом вуглецю СО2 і водяною парою Н2О, так звані реакції газифікації вуглецю. Таку назву ці реакції одержали тому, що в результаті їх протікання твердий вуглець перетворюється на газоподібні оксиди.
Газифікація вуглецю діоксидом вуглецю СО2 (реакція 4)
Рівняння реакції газифікації:
С + СО2= 2CO – Q; Δ G 0 = 172130 - 177,46· Т.
Реакція ендотермічна, її рівновага при підвищенні температури зміщується вправо. Протікання процесу залежить від загального тиску в системі. При пониженні тиску рівновага зміщується у бік утворення оксиду вуглецю (II) СО, тобто вправо.
За правилом фаз число ступенів свободи С = 2 + 2 – 2 = 2, тобто рівновага визначається двома змінними – температурою і тиском.
Вираз константи рівноваги входять тільки газоподібні компоненти, оскільки активність вуглецю приймається рівною 1  . Залежність константи рівноваги реакції (4) від температури описується рівнянням
. Залежність константи рівноваги реакції (4) від температури описується рівнянням  .
.
У простому випадку (за наявності в газі тільки СО і СО2) умови рівноваги визначаються рівнянням 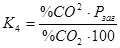 і оскільки газ полягає тільки із СО і СО2, то %СО2 = 100 – %CO, тоді
і оскільки газ полягає тільки із СО і СО2, то %СО2 = 100 – %CO, тоді  , у якому містяться три змінні величини Т, Рзаг і %СО. Проаналізуємо графік залежності рівноважного змісту СО від температури, побудований для тиску Рзаг =1 (рис. 3.5).
, у якому містяться три змінні величини Т, Рзаг і %СО. Проаналізуємо графік залежності рівноважного змісту СО від температури, побудований для тиску Рзаг =1 (рис. 3.5).

|
| Рис. 3.5 – Ізобара при Рзаг = 1 атм рівноважного складу газу залежно від температури для реакції С + СО2 = 2СО |
Їм можна користуватися для встановлення можливого напряму процесу при фіксованих концентраціях реагентів і температурі.
|
|
|
Рівняння ізотерми Вант-Гоффа для даної реакції має наступний вигляд:
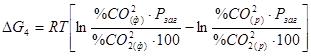 . Якщо Рзаг = const, той цей вираз перетвориться в
. Якщо Рзаг = const, той цей вираз перетвориться в 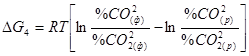 . Кожна крапка в площині креслення відповідає якійсь газовій суміші (із СО і СО2) у присутності твердого вуглецю, узятій при певній температурі. Але лише ті їх, які розташовані на кривій, характеризують рівноважні стани. Розглянемо крапку а вище кривій, належній нерівноважній системі. Тут, як видно з графіка, % СО(ф) > % CO(р) і % СО2(ф) < % CO2(р), звідки
. Кожна крапка в площині креслення відповідає якійсь газовій суміші (із СО і СО2) у присутності твердого вуглецю, узятій при певній температурі. Але лише ті їх, які розташовані на кривій, характеризують рівноважні стани. Розглянемо крапку а вище кривій, належній нерівноважній системі. Тут, як видно з графіка, % СО(ф) > % CO(р) і % СО2(ф) < % CO2(р), звідки  . Оскільки мимовільно процеси йдуть у бік меншого значення зміни вільної енергії Гіббса, то реакція повинна за вказаних умов протікати лише вліво С + СО2 → 2СО. Таким чином, крапки вище кривій характеризують нерівноважні системи, в яких можливий односторонній процес розпаду СО. Так само з'ясовуємо, що крапки нижче за криву відповідають нерівноважним системам, в яких можлива одностороння взаємодія С + СО2 → 2СО.
. Оскільки мимовільно процеси йдуть у бік меншого значення зміни вільної енергії Гіббса, то реакція повинна за вказаних умов протікати лише вліво С + СО2 → 2СО. Таким чином, крапки вище кривій характеризують нерівноважні системи, в яких можливий односторонній процес розпаду СО. Так само з'ясовуємо, що крапки нижче за криву відповідають нерівноважним системам, в яких можлива одностороння взаємодія С + СО2 → 2СО.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 470; Нарушение авторских прав?; Мы поможем в написании вашей работы!