
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Технологічні основи отримання порошків металів електролізом водних розчинів їх солей
Технологію отримання порошків металів електролізом їх солей можна поділити на два процеси. Перший – безпосередньо процес електролізу з отриманням рихлого (або компактного для отримання порошку заліза) осаду, а другий – його перероблення з отриманням порошку із заданими властивостями.
Електроліз проводять в електролізерах, які залежно від способу знімання осаду з катодів та видалення його з реактора, масштабів виробництва можуть мати різну конструкцію. Зазвичай в промислових умовах найчастіше використовують електролізерні ванни ящикового типу від 2 до 10 м3 . Корпус ванни можна виготовляти із залізобетону, металу або дерева, що футерують кислотостійким матеріалом – пластмасами, листовим сплавом свинцю із 6% сурми. Можливе також виготовлення корпусу ванни з вініпласту футерованого склом, який не потребує футерування.
Електролізер являє собою електрохімічну систему, яка складається з ванни, заповненої електролітом, у якій містяться катоди та аноди пристроїв для живлення та підведення струму, системи циркуляції електроліту, вивантаження рихлого осаду. Схему такого електролізеру показано на рис. 5.9. Однойменні електроди (катоди, аноди) умикають в електричний ланцюг паралельно. Електролізери, якщо їх декілька, вмикають в одне джерело струму послідовно, що зумовлює однакові умови їх живлення. Джерелом живлення постійного струму слугують тиристорні (силіцієві або германієві) випрямлячі.
Аноди виготовляють здебільшого у вигляді пластин або литва з металу, або сплаву на його основі, порошок якого отримують. Можливе також використання насипних анодів. У цьому разі як аноди використовують відходи виробництва – скрап або металеву стружку. Аноди, виготовлені з такого матеріалу, розчинні, тому їх періодично змінюють. Можливе також використання нерозчинних або малорозчинних анодів з графіту, свинцю.

Рис. 5.9. Схема поздовжнього перетину електролізера:
1 - карман для подачі електроліту; 2 – проміжна шина; 3 – аноди;
4 – катоди; 5 – відведення електроліту
Як катоди використовують неіржавійну сталь, алюміній, титан, графіт, мідь, катоди зі свинцево-сурьм’янистого сплаву. Вибір того чи того матеріалу для виготовлення катода обумовлено умовами проведення електролізу. Так, для отримання порошку міді електролізом катоди з алюмінію доцільно використовувати за густини струму електролізу понад 2500 А/м2 , відносно малих температур (30...35 0С) і вмісту в електроліті сірчаної кислоти 0,12...0,14 г/см3. Титанові катоди використовують при густині струму 1400...1600 А/см3, температурі – 35...40 0С і вмісті кислоти – не більше 0,1 г/см3. При цьому втрати матеріалу катода не перевищують 0,05...0,07 % на тонну продукту. Вибираючи матеріал катода, необхідно враховувати їх електропровідність та корозійну стійкість, які мають бути високими. Одна з вимог до катодів – висока чистота шліфованої поверхні, що значно полегшує знімання катодного осаду з поверхні катода.
Катоди можуть бути стаціонарними у вигляді пластин чи стрижнів, або рухомими у вигляді дисків, барабанів і стрічок.
Стабільність властивостей отримуваних порошків, за інших однакових умов, багато в чому залежить від методу знімання осаду з поверхні катодів. У цьому сенсі важливий вплив має періодичність знімання осаду, яка має бути однаковою. Для цього знімають осад через фіксовані проміжки часу (20...30 хв) механічним способом або за допомогою електричного імпульсу. В останньому випадку на електроди короткочасно подають імпульс струму високої напруги. Розряд, що при цьому виникає між електродами, створює ударну хвилю, яка й очищує катод від порошку. Для стабілізації властивостей порошків та проведення процесу в безперервному режимі доцільно проводити електроліз з використанням обертових катодів. Регулювати властивості отримуваних порошків у таких електролізерах можна, змінюючи швидкість обертання катода. Схему такого електролізера показано на рис. 5.10.
У процесі електролізу склад електроліту як за концентрацією солі металу, так і за його кислотністю постійно змінюються. Головна причина цього – різні значення коефіцієтів використання катодного (Кк) та анодного (Ка) струмів. Якщо припустити, що Ка = 1, то Кк може змінюватись у межах 0,85...0,92, що залежить від потенціалу виділення відповідних іонів металів, участі в перенесенні електрикиіонів водню та іонів елементів-домішок, наявності перенапруги і т.ін. У цьому разі в процесі електролізу (наприклад, для отримання порошку міді) буде перебігати реакція:
Cu + (1- Кк)Н2SO4 + I = КкCuк + (1-Кк)Н2 + (1-Кк)CuSO4,
де І – струм.
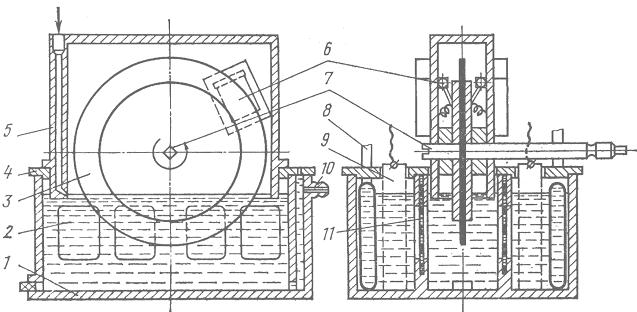
Рис. 5.10. Електролізер з обертовим катодом:
1 – корпус; 2 – отвори в перегородці; 3 – обертовий катод; 4 – кришка;
5 – катодна коробка; 6 – щітки для знімання осаду з катода; 7 – вал;
8 – холодильники; 9 – аноди; 10 – отвір для зливання електроліта;
11 _ діафрагма
Як наслідок під час електролізу буде відбуватись збільшення концентрації солей металів і відповідне зменшення кількості кислоти. Окрім того, можливе також розчинення металу в електроліті за реакцією
Cu + 1/2O2 + H2SO4 = CuSO4 +H2O,
що також буде сприяти збільшенню концентрації електроліту. Поряд з цим унаслідок розчинення анодів в електроліт будуть попадати іони інших елементів.
Таким чином, для отримання порошків металів електролізом розчинів їх солей актуальним є підтримання складу електроліту в заданих межах. Тільки у цьому випадку можливе отримання порошків із заданими властивостями. Підтримання складу електроліту в заданих межах забезбечують за допомогою системи циркуляції та регенерації електроліту (рис. 5.11.), яка дозволяє відводити його з електролізної ванни та коригувати склад введенням відповідної кількості кислоти та води.

Рис. 5.11. Схема циркуляції та регенерації електроліту:
1 –розподільна труба; 2 – розвідна труба; 3 – приймальний карман;
4 – ванна електролізера; 5 – зливний лоток; 6, 13 – введення відпрацьованого електроліту; 7 – бак кондиціювання електроліту; 8 – насос; 9 – теплообмінник;
10 – напірний бак; 11 – зливна труба; 12 – магістраль підведення відкоригованого електроліта; 14 – підведення технологічної води; 15 – підведення кислоти
Можливе також коригування складу електроліту електрохімічним способом, який дозволяє очистити електроліт від надлишку металу та регенерувати кислоту. У цьому разі система має вигляд:
Me|CuSO4, H2SO4, H2O|Me + ,
де Me + – нерозчинний анод.
У цій системі перебігає реакція
CuSO4 + H2O + 2е = Cu + 1/2O2 + H2SO4,
унаслідок якої з розчину виділяється метал, а на катоді – кислота. При цьому у процесі може виділятися як порошкоподібний метал, так і компактний.
Умови отримання порошків деяких металів наведено в табл. 5.5. Отриманий електролізом осад порошку по нахиленому чи конусному дну електролізера попадає у відстійники і після вивантаження з них промивається гарячою водою. Для цього можна використовувати
Таблиця 5.5
Режими отримання порошків деяких металів електролізом водних розчинів
| Порошок | Склад електроліту, г/л | Катодна густина струму, А/м2 | Температура, °С | Катод | Анод |
| Міді | CuSO4 (Cu2+) 22 …32 (9-12) H2SO4 – 120 … 180 | 1800... 3250 | 48…50 | Титан Мідь | Мідь |
| Заліза | FeSO4 – 75; K2SO4 – 50; NH4SO4 – 40; pH – 3,0 … 3,5 | 20... 25 | Алюміній Сталь | Залізо Свинець | |
| Компак-тний осад заліза | FeSO4 – 75; K2SO4 – 50; NH4SO4 – 40; pH – 3,0 … 3,5 | 400... 500 | 50... 54 | Неіржавіюча сталь | Мало вуглецева сталь |
| Нікелю | NiSO4 – 48; NH4Cl – 50; NaCl – 200; pH – 6,2 … 6,5 | 2500... 3000 | 50... 55 | Неіржавіюча сталь | Нікель |
| Срібла | AgNO3 – 20; NaNO3 – 50; HNO3 – 10; pH = 1 | Неіржавіюча сталь | Срібло |
спеціальні нутчфільтри, у яких порошок розміщується на перфарованому днищі. Зазвичай на промивання однієї тонни порошку витрачається 10 м3 води.
Для запобігання корозії порошку, спричиненої великою питомою поверхнею, після промивання водою його стабілізують обробленням розчинами (350...400 г/м3) органічних речовин – милом, милонафтою, бензотризолом. Витрати розчину цих речовин становлять 5...6 м3/т порошку. Після цього порошок промивають холодною водою та зневоднюють. Зневоднювати можна різними способами (випарюванням, продуванням стисненим повітрям), але найбільш прийнятний спосіб – використання центрофуг. У цьому разі вміст вологи в порошку після зневоднення не перевищує декількох відсотків. Отриманий таким чином порошок сушать, запобігаючи при цьому його окисненню. Сушіння можна провадити у вакуумних сушильних шафах, сушильних котлах, а також розпиленням або в киплячому прошарку шихти в середовищі відновлювального газу.
Якщо порошок отримано електролізом водних розчинів і він має підвищений вміст кисню (наприклад, порошки заліза), застосовують його відновлювальний відпал з використовуванням технологічних способів (методи отримання порошків відновленням їх оксидів та солей металів газами відновниками розглянуто в розділі 4).
Отримані за допомогою електролізу порошки мають розвинену поверхню, малу насипну щільність, відносно високу питому поверхню, високу формовність і пресованість.
|
|
Дата добавления: 2014-11-20; Просмотров: 860; Нарушение авторских прав?; Мы поможем в написании вашей работы!