
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постулат Планка
|
|
|
|
Смешение двух идеальных газов (изобарно-изотермический процесс). В смеси идеальных газов компоненты ведут себя независимо друг от друга, поэтому энтропия смеси идеальных газов является аддитивной функцией состава.
При смешении двух газов в количестве n 1 и n 2 при постоянных температуре и давлении после удаления разделяющей их перегородки каждый газ изменяет свой объем от первоначального до объема смеси, равного сумме исходных объемов (V = V 1 + V 2). Изменение энтропии при смешении является суммой изменения энтропии каждого газа при его изотермическом расширении. Принимая во внимание уравнение (II, 4), это изменение равно:
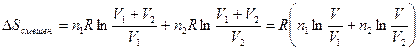 (II, 26)
(II, 26)
Гиббс в свое время обратил внимание на некоторую странность полученного результата. Если два газа идентичны, то состояния газов до и после удаления перегородки неотличимы. Следовательно, изменения энтропии системы после удаления перегородки не происходит, потому что начальное и конечное состояния одинаковы. Но для двух нетождественных газов, сколь бы малым ни было различие между ними, изменение энтропии системы при смешении определяется соотношением (II, 26). Обычно, в большинстве физических систем, малое изменение одной величины приводит к малому изменению другой зависимой величины. Иначе обстоит дело с энтропией смешения. Даже совершенно незначительное различие между двумя газами приводит к изменению энтропии. Если газы идентичны, то D Sсмешен. обращается в нуль. Такое скачкообразное поведение энтропии смешения называют парадоксом Гиббса.
По уравнению (II, 3) невозможно вычислить абсолютное значение энтропии системы. Такую возможность дает новое, недоказуемое положение, не вытекающее из двух законов термодинамики, которое было сформулировано М.Планком (1912). Согласно этому положению, называемому постулатом Планка, энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю:
|
|
|
S 0= 0
Строго говоря, постулат Планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены (в кристаллической решетке все узлы заняты молекулами или атомами, правильно чередующимися и закономерно ориентированными). Такие кристаллы называются идеальными твердыми телами. Реальные кристаллы не являются таковыми, так как их кристаллическая решетка построена не идеально.
Энтропия кристаллической решетки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
В соответствии с постулатом Планка уравнение (II, 25) для идеального твёрдого тела примет вид:
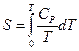 (II, 27)
(II, 27)
Постулат Планка используется при термодинамическом исследовании химических процессов для вычисления абсолютных значений энтропии химических соединений — величин, которые имеют большое значение при расчете химических равновесий.
Энтропия широко используется в технической термодинамике (теплотехнике), как один из важных параметров рабочего тела в тепловой машине, например, водяного пара. Величины энтропии водяного пара в данном состоянии вычисляются по сравнению с некоторым стандартным состоянием. Эти значения энтропии используются для построения так называемых энтропийных диаграмм состояния водяного пара в координатах S-Т или S-H (диаграмма Молье). В таких диаграммах подобно диаграммам
P – V можно изображать различные процессы, протекающие в рабочем теле тепловой машины и составляющие рабочие циклы машины.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!