
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартный электродный потенциал металла (Е0)
Классификация окислительно-восстановительных реакция (привести примеры, составить уравнения реакции)
Важнейшие окислители. Важнейшие восстановители.
окислитель содержит в своем составе элемент, понижающий степень своей окисленности, а восстановитель содержит элемент, степень окисленности которого повышается в ходе реакции. Следовательно, окислителями могут быть прежде всего соединения высших, а восстановителями — низших степеней окисленности, присущих данному элементу. Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителя или восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO3, H2SO4, HClO4, KMnO4, K2Cr2O7 и др.) или только восстановителями (NH3, H2S, галогеноводороды, Na2S2O3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H2O2, H2SO3 и др.).
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование, контрдиспропорционирование) — реакция, обратная диспропорционированию:HOCH+HCL→H2O+HL2
28.Электрохимические процессы. Электродный потенциал. Устройство и работа медно-цинкового гальванического элемента Даниэля. Схема гальванического элемента.
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы:
1) процессы превращения химической энергии в электрическую (в гальванических элементах);
2) процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы.
Простейшая модель строения металла следующая: в узлах кристаллической решетки находятся положительные ионы металла, которые прочно связаны подвижными электронами. При погружении металлической пластины в водный раствор соли этого же металла положительные ионы, находящиеся на поверхности металла, гидратируются и переходят в раствор. В результате этого перехода в кристаллической решетке металла оказывается избыток электронов и пластина приобретает отрицательный заряд. Между отрицательно заряженной пластиной и положительными ионами в растворе возникает электростатическое притяжение, в результате которого раствор у поверхности пластины приобретает положительный заряд. Одновременно развивается противоположный процесс: ионы металла из раствора принимают электроны с поверхности пластины и образуют атомы металла, которые становятся частью кристаллической решетки.
Через промежуток времени между металлической пластиной и раствором устанавливается состояние равновесия, при котором скорость перехода ионов из металла в раствор равна скорости разряжения ионов из раствора на поверхности металла:
Me + mH2O «Men+•mH2O + n 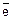
или упрощенно
Me «Men+ + n 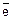
Таким образом, при контакте металла с раствором его соли поверхности этих фаз приобретают противоположные заряды – образуется двойной электрический слой и возникает разность потенциалов.
Система, состоящая из металлического проводника и раствора электролита, в который погружен проводник, называется электродом, а разность потенциалов на границе металл-электролит – электродным потенциалом
Электродный потенциал зависит от следующих основных факторов:
- природы металла;
- концентрации ионов металла в растворе;
- температуры.
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
Е 0 – равновесный стандартный потенциал.
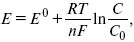
где С0 – стандартная концентрация раствора;
С – любая концентрация в нестандартных условиях, С = С0 x Е = Е 0, т. е. в стандартных условиях С = C0 = 1 моль.
Для окислительных веществ

По отношению к потенциалу стандартного водородного электрода потенциалы различных металлов располагаются в ряд стандартных электродных потенциалов или ряд напряжений (приложение, табл.5).
Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. И наоборот, чем более положителен потенциал электрода, тем большей окислительной способностью обладают его ионы.
Металлы, стоящие в ряду напряжений левее, вытесняют правее стоящие из растворов их солей.
Металлы, расположенные в ряду напряжений до водорода, вытесняют его из некоторых кислот.
Процессы, протекающие на границе металл-раствор, лежат в основе работы гальванического элемента – устройства для превращения энергии химической окислительно-восстановительной реакции в электрическую.
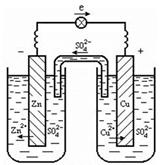
Гальванический элемент представляет собой электрохимическую систему, состоящую из двух металлических пластин, погруженных в растворы солей собственных ионов. Растворы соединяются солевым мостиком – стеклянной трубкой, заполненной электролитом KCl. Солевой мостик препятствует смешиванию растворов и проводит электрический ток.
Рассмотрим гальванический элемент Даниэля-Якоби, состоящий из медной и цинковой пластин, погруженных в растворы солей CuSO4 и ZnSO4, соответственно. Пока цепь разомкнута, на каждой из пластин устанавливается равновесие:
Zn0 «Zn2+ + 2 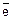
Cu0 «Cu2+ + 2 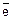
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении электродов металлическим проводником, избыточные электроны будут перемещаться с цинкового электрода на медный. В результате перехода электронов равновесие на цинковой пластине сместится вправо и в раствор перейдут новые количества ионов цинка. В то же время равновесие на медной пластине сместится влево и на поверхности пластины произойдет разряд ионов меди.
Таким образом, при замыкании цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и осаждение меди на медном электроде.
Движение анионов (SO42–) через солевой мостик замыкает электрическую цепь гальванического элемента.
В гальваническом элементе электрод, на котором идут процессы окисления, называют анодом, ему присваивают отрицательный заряд (–). Электрод, на поверхности которого идут процессы восстановления катионов металла из раствора, называют катодом и ему присваивают положительный заряд (+).
Гальванический элемент принято изображать в виде схемы:
(–) Zn | Zn2+ || Cu2+ | Cu (+)
анод катод
Анодный процесс: А(–): Zn0 - 2 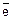 = Zn2+
= Zn2+
Катодный процесс: К(+): Cu2+ + 2 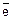 = Cu0
= Cu0
Суммарная
токообразующая Zn0 + Cu2+ = Zn2+ + Cu0
реакция: Zn + CuSO4 = ZnSO4 + Cu
Главной характеристикой гальванического элемента является электродвижущая сила (э.д.с.) Е, равная разности электродных потенциалов катода и анода:
Е = jк - jа.
Если э.д.с. измеряют при стандартных условиях, то ее рассчитывают по стандартным электродным потенциалам. Так, для гальванического элемента Даниэля-Якоби
E0 = j0Cu - j0Zn = 0,34 –(-0,76) = 1,1 В
Если условия отличны от стандартных, то величины электродных потенциалов рассчитывают по уравнениям Нернста.
Гальванический элемент из двух электродов, изготовленных из одного металла, но погруженных в растворы солей этого металла с различной концентрацией называют концентрационным.
Анодом в таком элементе будет пластина в растворе с меньшей концентрацией (С1), катодом – пластина в растворе с более высокой концентрацией (С2). Электродвижущую силу такого элемента рассчитывают по формуле:

Таким образом, концентрация первого раствора С1 будет постепенно увеличиваться, а второго раствора С2 – уменьшаться. Через некоторое время концентрации С1 и С2 станут одинаковыми, а э.д.с. – равной нулю.
|
|
Дата добавления: 2014-12-16; Просмотров: 802; Нарушение авторских прав?; Мы поможем в написании вашей работы!