
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
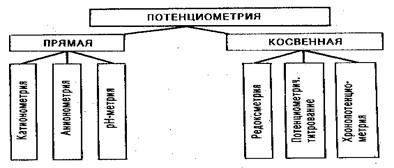
Потенциометрия
|
|
|
|
Электроды сравнения
Электроды, используемые в электрохимии
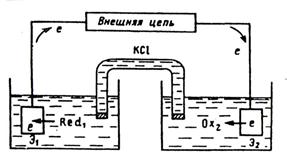
Электрохимическая ячейка
n Электроды первого рода (обратимые относительно катиона, общего с материалом электрода):
ü Металлические электроды;
ü Амальгамные электроды;
ü Газовые электроды (водородный).
n 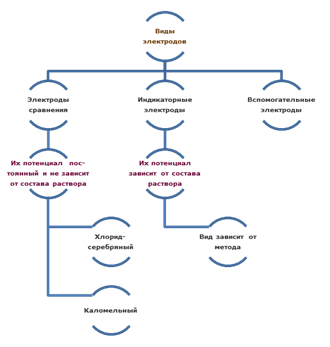 Электроды второго рода (обратимые относительно аниона, общего с материалом электрода):
Электроды второго рода (обратимые относительно аниона, общего с материалом электрода):
ü Электроды сравнения (хлоридсеребряный, каломельный);
ü Газовые электроды (хлорный).
n Электроды третьего рода (редокс-электроды):
ü Металлические электроды, погруженные в редокс-систему;
ü Хингидронный электрод.
Каломельный электрод:
Hg2Cl2Т + 2e = Hg + 2Cl-;
Е = +0,24 ± 0,10 В.
Хлоридсеребряный электрод:
AgClТ + e = Ag + Cl-;
Е = +0,22 ± 0,20 В
 |
В основе потенциометрического анализа – измерение ЭДС гальванического элемента, состоящего из индикаторного электрода и электрода сравнения, погруженных в анализируемый раствор:
ЭДС = ∆Е = Еэ.с. – Еи.э. + Ед
n В основе потенциометрических измерений лежит зависимость равновесного потенциала индикаторного электрода от состава и концентрации анализируемого раствора, описываемая уравнением Нернста (250С):
Е = Е0Ox/Red + (RT/nF) • ln(aOx / aRed) =
= Е0Ox/Red + (0,059/n) • lg(aOx / aRed),
где Е – равновесный электродный потенциал; n – число электронов, участвующих в полуреакции; Е0 – стандартный электродный потенциал; Т – абсолютная температура;
F – постоянная Фарадея; R – универсальная газовая постоянная.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 475; Нарушение авторских прав?; Мы поможем в написании вашей работы!