
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування сульфатів 4 страница
|
|
|
|
Залежно від їх вираженого типу зв'язку розрізняють три типи гідридів:
Іонні гідриди (солеподібні гідриди), в яких домінує іонний тип зв'язку; наприклад — гідрид натрію NaH, або кальцію CaH2;
Металеві гідриди, з домінуванням металічного зв'язку; MnH, CrH із структурою типу MnAs.
Ковалентні гідриди, з вираженим ковалентним зв'язком. До цього типу відносять LiAlH4, NaBH4 та ін.
До іонних (солеподібним) гідридів відносяться гідриди лужних і лужноземельних металів. Це білі кристалічні речовини, стійкі в звичайних умовах, які лише при нагріванні розкладаються без плавлення на метал і водень (окрім LIH, плавкого при 680°С). Водою енергійно розкладаються з виділенням водню. Виходять при взаємодії металів з воднем при 200—600°С. LIH і NAH застосовуються в органічному синтезі як відновники і агенти конденсації. CaH2 — для висушування і визначення води в органічних розчинниках, при отриманні порошків металів з оксидів, а також водню. Розчином NAH в розплавленому лузі знімають окалину з металевих виробів. Іонну будову мають і подвійні гідриди — борогідриди МеВН4 і алюмогідріди MeAlH4 (див. гідрид алюмінію), які широко використовуються в органічному синтезі як ефективні відновники.
Гідриди перехідних металів належать до типа металевих, оскільки за характером хімічних зв'язку вони схожі з металами. Ці гідриди в більшості випадків є сполуками змінного складу, і формули, що приводяться нижче, дають лише граничний вміст у них Гідрогену. Багато металів здатні поглинати значну кількість водню з утворенням твердих розчинів, що зберігають кристалічну структуру даного металу. Навпаки, достеменні гідриди мають структуру іншу, ніж вихідний метал. Для металів III групи періодичної системи (підгрупа Sc і лантаноїди) характерне утворення двох типів гідридів — MeH2 і MeH3. Метали IV групи (підгрупа Ti) утворюють гірдиди MeH2, а метали V групи (підгрупа ванадію) — MеH. Гідриди металів цих груп — крихкі тверді речовини сірого або чорного кольору, виходять при дії водню на дрібно раздробленні метали при підвищених температурах. Метали VI, VII і VIII груп (окрім паладію) при поглинанні водню не дають певних хімічних сполук.
Гідриди перехідних металів служать каталізаторами різних хімічних реакцій. Здатність металів утворювати гідриди використовується у високовакуумній техніці для скріплення водню. В результаті утворення гідридів, наприклад при дії пари води на розжарений метал і при електролітичному виділенні металів, погіршується якість металів (з'являється так звана воднева крихкість).
Гідриди перехідних металів I і II груп періодичної системи, а також гідриди III групи (підгрупа A1) не утворюються при взаємодії металу з воднем. Вони виходять, наприклад, при відновленні сполук цих металів алюмогидрідом літію LiAlH в ефірному розчині. Всі вони при нагріванні легко розкладаються на метал і водень.
Ковалентні гідриди утворюються неметалами IV, V, VI і VII груп періодичної системи, а також бором. Окрім простих сполук цього типу (метану CH4, силану SiH4 і т.п.), що є газами, відомі гідриди з великим числом атомів елемента, сполучених один з одним у вигляді ланцюгів, наприклад силани Sin H2n+2. Простий гідрид бору ВН3 не існує, бороводні мають складну будову. Гідриди елементів перших періодів дуже стабільні, гідриди важких елементів украй нестійкі. Чимало гідридів (B2H6, SiH4, PH3) легко загоряються на повітрі. B2H6 і SiH4 розкладаються водою з виділенням водню. Гідриди елементів V, VI і VII груп водою не розкладаються. Відомі численні похідні ковалентних гідридів, в яких частина атомів водню заміщена на атоми галогену або металу, а також на алкільні та інші групи. Ковалентні гідриди отримують безпосередньою взаємодією елементів, розкладанням сполук металів водою або кислотами, відновленням галогенідів і інших сполук гідридами борогідридами і алюмогидридамі лужних металів. Термічне розкладання гідридів служить одним з методів отримання особливо чистих елементів (наприклад, кремнію, германію).
3.2.3 Оксиди
В залежності від хімічних властивостей розрізняють:
- солетвірні оксиди:
- основні оксиди (наприклад, оксид натрію Na2O, оксид міді (II) CuO); Оксиди металів, валентність яких I-II, крім ZnO;
- кислотні оксиди (наприклад, оксид сірки (VI) SO3, оксид азоту (IV) NO2); Оксиди металів з валентністю V-VII і оксиди неметалів.
- амфотерні оксиди (наприклад, оксид цинку ZnO, оксид алюмінію Al2О3); Оксиди металів з валентністю III-IV і ZnO.
- несолетвірні оксиди (наприклад, оксид вуглецю (II) СО, оксид азоту (I) N2O, оксид азоту (II) NO, оксид кремнію (II) SiO).
Номенклатура.
Відповідно до номенклатури ІЮПАК, оксиди називають словом «оксид», після якого слід найменування хімічного елемента в родовому відмінку, наприклад: Na2O - оксид натрію, Al2O3 - оксид алюмінію. Якщо елемент утворює кілька оксидів, то в їхніх назвах вказується його ступінь окислення римською цифрою в дужках відразу після назви (без пробілу). Наприклад, Cu2О - оксид міді (I), CuO - оксид міді (II), FeO – оксид заліза (II), Fe2О3 - оксид заліза (III), Cl2O7 - оксид хлору (VII).
Часто використовують і інші найменування оксидів за числом атомів кисню: якщо оксид містить тільки один атом кисню, то його називають монооксидом або закисом, якщо дві - діоксидом або двоокисом, якщо три - то триоксид або триокису і т. д. Наприклад: монооксид вуглецю CO, діоксид вуглецю СО2, триоксид сірки SO3. Також поширені історично склалися (тривіальні) назви оксидів, наприклад чадний газ CO, сірчаний ангідрид SO3 і т. д.
Хімічні властивості: Основний оксид.
1. Основний оксид + кислота = сіль + вода
CuO + H2SO4 = CuSO4 + H2O
Контрольні запитання:
1. Чим визначається належність елементів до s-електронної родини?
а) атомною массою; б) порядковим номером;
в) кількістю енергетичних рівнів;
г) знаходженням всіх валентних електронів на зовнішньому s-підрівні.
2. Завдяки якому явищу залізо може існувати в α-, β-, γ - і δ-модифікаціях?
а) алотропія; б) ізотопія; в) поліморфізм; г) ізомерія.
3. До якої родини за природним походженням належить барій?
а) лужні; б) лужноземельні; в) рідкоземельні; г) поширені.
4. Зазначте найважчий метал.
а) Os; б) Cu; в) Pb; г) Hg.
5. Якою є температура, вище якої плавляться метали тугоплавкої групи?
а) >1000oC; б) >1350oC; в) >1800oC; г) >1500oC.
6. Метали виявляють таку характерну ознаку: підвищена хімічна стійкість відносно окиснювальних і агресивних реагентів. До якої класифікаційної групи належать такі метали?
а) рідкі; б) розсіяні; в) благородні; г) інертні.
7. Нижче якої величини повинна бути густина металу, щоб віднести його до групи легких металів?
а) <3,5г/см3; б) <5,0г/см3; в) <3,0г/см3; г) <5,3г/см3.
8. До якої групи металів належать технецій 43Tc, прометій 61Pm, полоній 84Po і всі метали з більшими, ніж у полонія атомними номерами?
а) рідкоземельні; б) рідкі; в) радіоактивні; г) розсіяні.
9. Назвіть найлегкоплавкіший метал.
а) Fr; б) Cs; в) Ga; г) Hg.
10. Який метал є найлегшим?
а) Li; б) Na; в) Mg; г) Al.
11. Які ступені окисненя можуть виявляти s-метали ІІ групи у сполуках?
а) +1; б) +2; в) -1; г) -2.
12. Які s-елементи не належать до металів?
а) Na, K; б) H, He; в) Sr, Sc; г) Fr, Ra.
13. Якими є значення стандартних електродних потенціалів для лужних металів?
а) < -2,5B; б) > -2,5B; в) >-0,43B; г) < -3,5B.
14. Яка властивість металічного зв’язку забезпечує теплопровідність металів?
а) ненасиченість; б) багатоелектронність;
в) багатоцентровість; г) ненапрямленість.
СРС
Тема 3.3 Поширеність металічних елементів та їхніх сполук у природі.
План:
3.3.1Металеві властивості елементів
3.3.2 Елементи-метали в Періодичній системі
3.3.3 Метали в природі
3.3.1Металеві властивості елементів
Металеві властивості елементів характеризуються їх здатністю порівнянно легко віддавати електрони при утворенні хімічного зв’язку.
В періодах металеві властивості єлементів зменьшуються зі збільшенням порядкового номеру у зв’язку зі збільшенням кількості електронів на зовнішньому рівні і зменьшенням радіусу атома, в групах зверху вниз металеві властивості збільшуються завдяки збільшенню радіусу атома. Кількість електронів у цьому випадку не змінюється
У будові атомів металічних елементів є ряд особливостей.
Завдання:
Використовуючи Періодичну таблицю дайте відповідь на запитання: чи є вільні орбіталі на зовнішньому рівні у атомів металічних елементів головних підгруп? Побічних підгруп? Порівняйте кількість енергетичних рівнів в атомах металічних і неметалічних елементів.
Після аналізу будови атомів можна зробити такі висновки: у металевих елементів на зовнішньому енергетичному рівні порівнянно мало електронів і є вільні валентні орбіталі. Наприклад, в атомах лужних, лужноземельних металічних елементів та елементів III групи є відповідно 1, 2 або 3 електрони на зовнішньому рівні. В атомах електрони зовнішніх рівнів розташовані порівняно далеко від ядра.
У металічних елементів побічних підгруп (d– та f– елементів) електронами заповнюється передостанній рівень, а на зовнішньому рівні розміщується 1 або 2 електрони. Валентні електрони d–елементів розміщуються на зовнішній s- та d-підоболонках.
Валентними називають електрони, які розташовані на зовнішньому (для d-елементів і на передзовнішньому) енергетичному рівні і здатні утворювати хімічний зв’язок.
Атоми металічних елементів порівняно легко віддають електрони, перетворюючись у позитивно заряджені йони. Це їх характерна риса.
3.3.2 Елементи-метали в Періодичній системі
Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп).
Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів:
— мале число електронів на зовнішньому енергетичному рівні та є вільні валентні орбіталі (лужні, лужноземельні метали, метали III групи);
— електронами заповнюється передостанній енергетичний рівень; на зовнішньому рівні один або два електрони (метали побічних підгруп, d-елементи);
— електрони розміщуються відносно далеко від ядра (Полоній, Бісмут, Стибій).
Фізичні властивості металів
Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал — золото. Марганець і бісмут — крихкі метали.
Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал.
Електрична провідність. Вільні електрони під впливом різниці потенціалів набувають направленого руху від негативного полюса до позитивного. Найбільшу електричну провідність мають срібло і мідь.
Теплопровідність. Зумовлена рухом вільних електронів. Найбільша теплопровідність у срібла й міді, найменша — у вісмуту та ртуті.
Густина, температури плавлення і кипіння, твердість металів різні. Метали з густиною, меншою за 5 г/см3, називаються легкими, інші — важкими. Метали з температурою плавлення понад 1000 °С називаються тугоплавкими, нижче — легкоплавкими.
3.3.3 Метали в природі
У природі метали існують переважно у вигляді сполук: оксидів, сульфідів, сульфатів, хлоридів, карбонатів і т. д. У вільному стані в земній корі зустрічаються найменш активні метали — золото, платина. Мідь, ртуть, срібло, олово можуть траплятися як у саморідному стані, так і в складі сполук.
Мінерали й гірські породи, що містять метали та їх сполуки та є придатними для промислового добування металів, називаються рудами.
Деякі різновиди металічних руд:
-оксидні руди,
-сульфідні руди,
-хлоридні руди;
-карбонатні руди.
Контрольні запитання:
1.Металоїди, Напівметали
2. Корозія металів
3. Сплави металів
4. Металічні корисні копалини
5. самородні метали
6. Використовуючи Періодичну таблицю дайте відповідь на запитання: чи є вільні орбіталі на зовнішньому рівні у атомів металічних елементів головних підгруп?
7. Побічних підгруп?
8. Порівняйте кількість енергетичних рівнів в атомах металічних і неметалічних елементів.
Лекція 9 (заняття 13)
Тема 3.4 Алюміній. Фізичні та хімічні властивості. Амфотерний характер його сполук.
План:
3.4.1 Алюміній. Фізичні та хімічні властивості.
3.4.2 Термодинамічні властивості
3.4.3 Хімічні властивості.
3.4.4 Застосування алюмінію
3.4.1 Алюміній. Фізичні та хімічні властивості.
Алюмі́ній (Al) (рос. алюминий, англ. aluminium, нім. Aluminium) — хімічний елемент III групи періодичної системи, йогоатомний номер 13, відносна атомна маса 26,9815. В природі існує єдиний стабільний ізотоп 27Al. Третій за вмістом елемент (і найпоширеніший метал) земної кори, що становить приблизно 8% від її маси.
Історія
Назва алюміній походить від слова alumen (галун), яке в свою чергу виникло заІсідором (VII ст. до н. е.), в зв'язку з застосуванням цієї речовини в якості протрави для фарбування: «Alumen vocatur a lumin e, quod lumen coloribus praestat tingendis»[2]. Пліній описує галуни і їх затосування і знаходить згадку про них ще вГеродота (V ст. до н. е.) під назвою σττπτηρία. Однак в той час галуни (тобто KAl(SO4)2·12H2O) не відрізняли від сполук, діючих аналогічно їм, наприкладзалізного купоросу. В чистому вигляді галуни були отримані, очевидно, алхіміками.Земля, яка була в основі галунів, тобто оксид алюмінію, була вперше отримана в1754 році Маргграфом, і пізніше отримала назву глинозем.
Гемфрі Деві в 1808 році визначив існування металу основи галунів, і назвав йогоалюміум, а пізніше алюмінум. Протягом 1808—1810 років він намагався електролітично виділити цей метал з глинозему, проте це йому не вдалось.
Вперше отримати металевий алюміній вдалося датському фізику Гансу Крістіану Ерстеду в 1825 році, термічним відновленням безводного хлориду алюмініюамальгамою калію.
Цей спосіб був вдосконалений Фрідріхом Велером, який замість амальгами застосував чистий калій в 1827 році. Веллеру також належить перший приблизно точний опис властивостей металу.
У 1854 році Анрі Сент-Клер Девіль вдосконалив метод Веллера і налагодив промислове виробництво алюмінію. Девіль в процесі отримання алюмінію замінив калій дешевшим натрієм, а також хлорид алюмінію сумішшю AlCl3 з NaCl, за рахунок чого компоненти суміші знаходились в розплавленому стані. Досліди на заводі Жавеля завершились успішно і 18 липня 1855 року були отримані перші злитки металу масою 6-8 кг, які і були показані на Всесвітній виставці в Парижі. В той час алюміній був настільки дорогим, що на виставці він був виставлений поряд з скарбами з державної казни, а імператор Наполеон III використовував посуд з алюмінію на державних прийомах.
У 1865 році російський вчений Микола Бекетов застосував реакцію взаємодії між кріолітом і магнієм для отримання алюмінію. Його спосіб мало чим відрізнявся від способа Девілля, але був простішим. В німецькому місті Гмелінгемі в 1885році був збудований завод, який працював за методом Бекетова, де за п'ять років було отримано 58 т алюмінію — більше 1/4 всього світового виробництва алюмінію протягом 1854—1890 років[4].
Добування алюмінію хімічним способом не могло забезпечити промисловість дешевим металом, тому дослідникам довелось шукати інших способів виробництва алюмінію.
Ще в 1854 році Бунзену вдалось отримати алюміній електролітичним шляхом, а саме електролізом подвійного хлориду натрію і алюмінію.
В 1886 році Пауль Еру в Франції і Чарльз Холл в США майже одночасно, незалежно один від одного запропонували добувати алюміній електролізом глинозему, розплавленного в кріоліті, чим започаткували сучасний спосіб добування алюмінію. Світове виробництво алюмінію швидко росло і в 1893 році перевищило 1 тис. тон в рік. Подальші зміни цін на нього показано в таблиці.
Фізичні властивості
Алюміній — сріблясто-білий легкий метал, добрий провідник тепла і електрики, пластичний, легко піддається механічній обробці.
Кристалічна структура і атомний радіус
Алюміній має кубічну гранецентровану кристалічну ґратку (просторова група Fm3m). Найближча відстань між двома атомами становить 2,863Å. Прийнятий період кристалічної ґраткиалюмінію a = 4.0414 Å при кімнатній температурі. Кристалічна ґратка стабільна при температурах від 4К і до температури плавлення 933К. Параметр ґратки дуже слабо змінюється від наявності домішок.
Атомний радіус алюмінію визначений як половина між найближчими атомами-сусідами в кристалічній структурі і рівний 1,43Å. В кристалічній структурі алюмінію металічний зв'язок.
Густина
Теоретична густина алюмінію обрахована за параметрами його кристалічної гратки становить 2,69872 г/см3. Експериментальні дані густини для полікристалічного алюмінію 99,996% чистоти становлять 2,6989 (при 20 °C) г/см3, а для монокристалів — на 0,34% вище.
Так, густина розплавленого алюмінію чистотою 99,996% на 6,6% менше, ніж у твердого металу, і при температурі 973 К складає 2357 кг/м3 і майже лінійно знижується до 2304 кг/м3 при температурі 1173 К.
Термічне розширення
Коефіцієнт термічного розширення α відпаленого алюмінію чистотою 99,99% при температурі 293 К складає 23·10−6 і практично лінійно зростає до 37,3·10−6 К−1 при температурі 900 К.
Теплопровідність
Теплопровідність повністю відпаленого алюмінію в твердому стані знижується з ростом температури від 2,37 (298 К) до 2,08 Вт·см−1·К−1 (933,5 К) і при температурах вище 100 К вона малочутлива до чистоти металу.
При нагріванні алюмінію і переході його з твердого стану в рідкий у нього різко зменшується теплопровідність: з 2,08 до 0,907 Вт·см−1·К−1, а далі з ростом температури вона збільшується і при температурі 1000 °C складає вже 1,01 Вт·см−1·К−1.
Електропровідність
Питомий опір алюмінію високої чистоти (99,99%) при температурі 20 °C складає 2,6548·10−8. Провідність алюмінію сильно залежить від його чистоти, причому вплив різних домішок залежить не тільки від концентрації цієї домішки, а й від того чи вона знаходиться в твердому розчині чи поза ним. Найбільш сильно підвищують опір алюмінію домішки хрому, літію, мангану, магнію,титану і ванадію. Питомий опір ρ (мкОм·м) відпаленого алюмінієвого дротика в залежності від вмісту домішок (%) можна приблизно визначити за наступною формулою:
ρ = 0,0264 + 0,007Si + 0,0007Fe + 0,04(Ti + V + Cr +Mn)
При температурі 1,175 ± 0,001 К алюміній переходить в надпровідний стан.
Питомий опір алюмінію при переході з твердого стану в рідкий стрибком зростає з 11 до 24 МкОм·см.
Плавлення і кристалізація
Температура плавлення алюмінію дуже чутлива до чистоти металу і для високочистого алюмінію (99,996%) становить 933,4 К (660,3 °C), а температура початку кристалізації алюмінію заМіжнародною шкалою температур (1968 р.) вважається рівною 660,37 °C і використовується протягом десятків років для калібрування термопар. Підвищення зовнішнього тиску збільшує температуру плавлення алюмінію, і вона досягає 700 °C при тиску близько 100 МПа.
Температура кипіння алюмінію становить приблизно 2452 °C, прихована теплота плавлення чистого алюмінію — 397 Дж·г−1, а прихована теплота випаровування 9462Дж·г−1.
Питома теплоємність Ср алюмінію при 0 °C становить 0,90 Дж·г−1·К−1, зі збільшенням температури воні зростає і визначається рівнянням:
Ср = С0 + bT,
де С0 — теплоємість при температурі 0 °C; b = 2,96·10−3; T — температура, К.
Поверхневий натяг
Поверхневий натяг σ має максимальне значення при температурі плавлення і з ростом температури він знижується:
σ = 868 — 0,152(t — tп),
де σ — поверхневий натяг, Н/м; t — температура, °C; tп — температура плавлення алюмінію, °C.
В'язкість
В'язкість алюмінію при температурі плавлення становить 0,012 Па·с і збільшується при наявності навіть невеликого вмісту твердих включень, наприклад, оксиду алюмінію і нерозчинних домішок. З ростом температури в'язкість знижується. Легуючі добавки Ti, Fe, Cu збільшують, а Si і Mg знижують в'язкість сплаву.
3.4.2 Термодинамічні властивості
Основні термодинамічні властивості алюмінію в рідкому і твердому станах наведені в таблиці (температура в Кельвінах, теплоємність, ентропія і ентальпія в Дж·моль−1·К−1).
| Термодинамічні характеристики алюмінію | |||
| Температура T | Теплоємність Cp | Ентропія S | Ентальпія H-H298 |
| 0,000 | 0,000 | -4,580 | |
| 21,59 | 19,14 | -2,290 | |
| 25,64 | 35,68 | 2,550 | |
| 28,12 | 46,53 | 7,920 | |
| 30,64 | 54,96 | 13,790 | |
| 29,31 | 73,29 | 30,620 | |
| 29,31 | 78,64 | 36,480 | |
| 29,31 | 83,15 | 42,340 |
'Алюміній належить до головної підгрупи третьої групи періодичної системи елементів, його порядковий номер — 13. Електронна конфігурація алюмінію — 1s22s22p63s23p1. На зовнішньому енергетичному рівні знаходиться три валентних електрони, тому в хімічних сполуках алюміній зазвичай трьохвалентий. Менш характерні ступені окиснення +1 і +2, можливі тільки вище 800 °C в газовій фазі. Енергія іонізації алюмінію Al0 → Al+ → Al2+ → Al3+ відповідно дорівнює 5,984, 18,828, 28,44 еВ.
Спорідненість до електрона 0,5 еВ. Електронегативність за Полінгом 1,61, атомний радіус 0,143 нм, йонний радіус Al3+ (в дужках вказанні координаційні числа) 0,053 нм (4), 0,062 нм (5), 0,067 нм (6).
3.4.3 Хімічні властивості.
Алюміній — хімічно активний елемент. У електрохімічному ряді напруг він стоїть поруч з лужними і лужноземельними елементами. Його стандартний електродний потенціал рівний −1,67 В.
При звичайних умовах алюміній легко взаємодіє з киснем повітря і вкривається тонкою (2·10−5 см), але міцною оксидною плівкою Аl2О3 (пасивація), яка захищає його від дальшого окислення, обумовлюючи цим високу корозійну стійкість, надає йому матового вигляду і сіруватого кольору. Однак при вмісті в алюмінію чи навколишньому середовищі ртуті, натрію,магнію, кальцію, силіцію, міді і деяких інших елементів міцність оксидної плівки і її захисні властивості різко знижуються.
При 25 °C алюміній реагує з хлором, бромом, йодом утворюючи відповідно хлорид алюмінію AlCl3, бромід алюмінію AlBr3, йодид алюмінію AlI3, при 600 °C — з фтором утворюючи фторид алюмінію AlF3.
Порошкоподібний алюміній при температурі вище 800 °C утворює з азотом нітрид алюмінію. При взаємодії атомарного водню з парами алюмінію при −196 °C утворюється гідрид (AlH)x (x=1, 2). Вище 200 °C алюміній реагує з сіркою даючи сульфід Al2S3. З фосфором при 500 °C утворює фосфід AlP. При взаємодії розплавленого алюмінію з бором утворюються бориди AlB2, AlB12. При 1200 °C алюміній реагує з вуглецем утворюючи карбід алюмінію Al4C3. В присутності розплавлених солей (кріоліт та ін.) ця реакція протікає при меншій температурі — 1000 °C
Вище 800 °C можуть утворюватись сполуки одновалентного алюмінію, наприклад 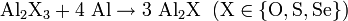
З рядом металів і неметалів алюміній утворює сплави, в яких містяться інтерметалічні сполуки — алюмініди, зазвичай досить тугоплавкі і володіють високою твердістю і жаростійкістю.
Завдяки утворенню оксидної плівки алюміній досить стійкий не тільки у відношенні повітря, а й води. З водою алюміній не взаємодіє навіть при нагріванні. Але коли оксидну плівку зруйнувати, алюміній енергійно взаємодіє з водою, витісняючи водень:
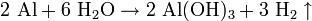
Алюміній має амфотерні властивості, він реагує з кислотами і лугами.
Він легко взаємодіє з розбавленими азотною і сульфатною кислотами:
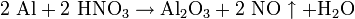

Дуже розбавлені, а також дуже міцні HNO3 і H2SO4 на алюміній майже не діють. У відношенні до ортофосфатної і оцтової кислот алюміній стійкий. Чистий метал також стійкий до хлоридної кислоти, але звичайний технічний в ній розчиняється.
У розчинах сильних лугів (NaOH, KOH) алюміній розчиняється з виділенням водню і утворенням алюмінатів:
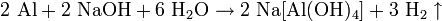
Досить енергійно він роз'їдається також розчином NH4OH.
3.4.4 Застосування алюмінію
Широке застосування алюмінію зумовлене його властивостями. Поєднання легкості з достатньо високою електропровідністю дозволяє застосовувати алюміній як провідник електричного струму. Алюміній і його сплави використовують практично у всіх галузях сучасної техніки: в авіаційній й автомобільній промисловості, залізничному і водному транспорті, машинобудуванні тощо. Завдяки високій корозійній стійкості алюміній широко застосовують при виготовленні апаратури для виробництва харчових продуктів та деяких хімічних речовин. З полірованого алюмінію виготовляють дзеркала та поверхні нагрівальних і освітлювальних рефлекторів. Алюміній використовують як розкисник сталей та інших сплавів. Ним відновлюють метали з їхніх оксидів.
Контрольні запитання:
1 Загальне визначення алюмінію
2 Історія отримання алюмінію
3. Класифікація алюмінію за ступенем чистоти і його механічні властивості
4. Основні легуючі елементи в алюмінієвих сплавах і їх функції
5. Застосування алюмінію і його сплавів у промисловості та побуті
6. Алюміній - матеріал майбутнього
Лекція 10 (заняття 14)
Тема 3.5 Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості заліза, сполуки Феруму (ІІ) і Феруму (ІІІ). Метали та сплави у сучасній техніці.
План:
3.5.1 Ферум як представник металічних елементів побічних підгруп.
3.5.2 Поширення в природі
3.5.3 Історія заліза
3.5.4 Отримання заліза
3.5.5 Фізичні та хімічні властивості
3.5.6 Застосування
3.5.1 Ферум як представник металічних елементів побічних підгруп.
Залі́зо — хімічна речовина, яка складається з феруму — хімічного елемента з атомним номером 26, що позначається в хімічних формулах символом Fe (від англ. Ferrum).
Атомна маса заліза 55,847. Це сріблясто-сірий, пластичний і ковкий метал, який легко окиснюється утворюючи оксиди феруму в вигляді товстої плівки (іржі), що сповільнюють подальше руйнування заліза. Залізо електропровідний метал. Йоготвердість за Брінеллем не перевищує 100 HB; модуль Юнга 190-210·103 МПа; модуль зсуву 8,4·103 МПа; границя міцності на розрив 170—210 МПа, границя текучості — 100 МПа; ударна в'язкість 300 МПа; середня питома теплоємність (273—1273 К) 640,57 Дж/кг·К; густина 7840 кг/м3. На повітрі окиснюється, вкриваючись іржею FeO·nH2O. Серед інших породоутворюючих елементів має максимальну атомну масу.
Походження назви
Наукова назва хімічного елемента і термін у романських мовах (італ. ferro, фр. fer, ісп. hierro, порт. ferro, рум. fier) походить від латинського слова «феррум» (лат. ferrum). Латинське ferrum, скоріш за все, запозичено із якоїсь східної мови, ймовірно зфінікійської (для порівняння: івр. barzel, шумерськ. barzal, ассирійськ. parzilla).
Германські мови запозичили назву заліза (готськ. eisarn, англ. iron, нім. Eisen, нід. ijzer, дан. jern, швед. järn) з кельтських мов.
3.5.2 Поширення в природі
За поширеністю в природі ферум посідає друге місце серед металів (після алюмінію). На нього припадає 5,10% маси земної кори. За вмістом у земній корі ферум посідає 4-е місце. Зустрічається він виключно у вигляді сполук. Вільне залізо знаходять лише в метеоритах.
Ферум — поширений елемент метеоритної речовини: в кам'яних метеоритах міститься до 25%, а в залізних 90,85 мас.% Fe. Космічна поширеність заліза близька до його вмісту в фотосфері Сонця — 627 г/т. Частка феруму в речовині Землі досить велика — 38,8%. Найбідніша на ферум поверхня Землі.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 810; Нарушение авторских прав?; Мы поможем в написании вашей работы!