
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАКОН ГЕССА 1 страница
|
|
|
|
ПЛАН
ВСТУП
ВИВЧИВШИ ТЕМУ, ВИ ПОВИННІ:
Знати:
P значення, мету та завдання фізичної хімії;
P основні етапи розвитку фізичної хімії;
P сучасний стан та тенденції розвитку фізичної хімії;
P значення фізичної хімії в технохімічному контролі харчових виробництв;
P місце фізичної хімії в підготовці спеціаліста.
Хімічні науки вивчають особливу «хімічну» форму руху матерії, коли одні речовини перетворюються в інші. Кожний хімічний процес – сукупність кількох послідовних стадій різної природи. Для того, щоб молекули реагували, їм перш за все необхідно зустрічатись, тобто фізичне переміщення молекул є неодмінною умовою кожного хімічного перетворення. Будь-яка перестановка атомів або груп атомів в молекулах завжди супроводжується поглинанням чи виділенням енергії. Закони перенесення тепла та інших видів енергії вивчає фізика. Хімічні реакції у батареях чи акумуляторах є причиною виникнення електричного струму. З наведених прикладів, кількість яких можна збільшувати, видно, що власне хімічне перетворення речовин завжди поєднане з фізичними процесами.
Близька спорідненість хімії і фізики прослідковується і з суто експериментальної точки зору. Ще 250 років тому, коли сучасна хімія тільки почала зароджуватись, витісняючи містику середньовічної алхімії, хімікам знадобились ваги, прилади для визначення об’єму, тиску, температури та інших фізичних параметрів. З іншого боку, фізикам стали потрібні відомості про склад речовини, ступінь її чистоти та інша хімічна інформація.
Уперше близькість і тісний зв’язок фізики і хімії помітив славетний російський вчений М.В.Ломоносов (1711-1765). Він сформулював низку фундаментальних законів, що стали основою не лише хімії і фізики, а й всього природознавства. Перш за все це закон збереження ваги (маси) при хімічних перетвореннях і закон збереження руху (енергії). У 1749р. Ломоносов писав, що всі зміни, які відбуваються в природі, йдуть таким чином, що скільки до чого чогось додається, стільки ж віднімається від іншого. Цей закон природи настільки загальний, що сягає і на правила руху, і тіло, що збуджує поштовхом до руху інше тіло, стільки втрачає свого руху, скільки віддає його від себе іншому тілу. Саме Ломоносов запропонував створити нову самостійну галузь знань на межі хімії і фізики, нову науку, яку назвали фізичною хімією.
|
|
|
Фізична хімія – наука, що вивчає фізичні та хімічні явища, які відбуваються одночасно і залежать одне від одного.
Найважливіші теоретичні та експериментальні дослідження Ломоносова мають велике значення і в наші часи.
Подальшому розвитку фізичної хімії сприяли роботи Д.І.Менделєєва. Відкриття періодичного закону, вивчення властивостей газів, розчинів зробило великий внесок у розвиток фізичної хімії.
Через 100 років після смерті М.В.Ломоносова фізична хімія як окрема самостійна наука відродилася в Україні. У 1860р. професор М.М.Бекетов почав читати в Харківському університеті курс «Взаємовідносини фізичних і хімічних явищ між собою», який у 1865р. перетворив у курс фізичної хімії. Він же написав підручник, організував на хімічному факультеті перше у світі фізико-хімічне відділення.
Кінець ХІХ століття відзначився бурхливим розвитком фізичної хімії, який значно випереджував темпи розвитку інших галузей хімії. Головні причини, які стимулювали прискорений розвиток фізичної хімії, такі:
1. Успіхи теоретичної й експериментальної фізики. Фізична наука почала розкривати будову молекул і атомів, виникли нові теорії, нові ефективні прилади і методи.
2. Досягнення і потреби хімії, яка до того часу нагромадила значний експериментальний матеріал, але все ще більше була схожа на мистецтво, ніж на науку. Хімії потрібна була струнка, теоретично обґрунтована систематизація всього набутого матеріалу.
|
|
|
3. Потреби хімічної індустрії, яка в ті часи розвивалась дуже швидко. Для проектування потужних реакторів і визначення оптимальних умов їх експлуатації потрібні були чіткі, теоретично обґрунтовані закони і точні рівняння, а не емпіричні залежності і правила.
Фізична хімія перейняла на себе функцію моста, який поєднав три, відокремлені в той час континенти – хімію, фізику і технологію. У розвиток фізичної хімії зробили внесок вчені всього світу. Шеєле в Швеції (1773) і Фонтана у Франції (1785) відкрили явище адсорбції із розчинів. Лавуазьє і Лаплас у Франції (1779-1784) вивчали теплові ефекти реакцій. На початку ХІХст. Деві в Англії і Тенар у Франції відкрили каталітичні реакції, а Берцеліус у Швеції (1835) зробив подальший внесок у розвиток вивчення явища каталізу.
Гальвані і Вольта в Італії (1779) запропонували перший гальванічний елемент. Деві (1800) висунув електрохімічну теорію взаємодії речовин. Фарадей (1833-1834) сформулював кількісні закони електролізу.
У першій половині ХІХст. завдяки працям Д.Дальтона в Англії (1801-1803), Л.Гей-Люссака у Франції (1802) та А.Авогадро в Італії (1811), що відкрили найважливіші закони газоподібних речовин, отримано широкий розвиток атомістичним уявленням. В цей період Г.І.Гесс (1802-1856) зробив свої відкриття в галузі термохімії.
Вагомим вкладом у розвиток фізичної і колоїдної хімії є внесок українських вчених, перш за все професора Київського університету І.Г.Борщова (1833-1878), професора М.М.Бекетова (1826-1911), академіків Академії наук України Л.В.Писаржевського (1874-1938), А.В.Думанського (1880-1967), О.І.Бродського (1895-1969), В.А.Ройтера (1903-1973).
В результаті багаторічних досліджень і наукових розробок чітко визначився предмет і завдання фізичної хімії.
Фізична хімія – це самостійна фундаментальна наука, яка вивчає взаємозв’язки фізичних і хімічних явищ та узагальнює фактичний матеріал різних розділів хімії, формулює загальні закономірності перебігу хімічних перетворень.
Завдання фізичної хімії – чітке формулювання загальних законів протікання хімічних реакцій та описання їх математичними рівняннями.
|
|
|
Знання цих законів і відомостей про будову й властивості молекул реагентів дозволяє теоретично передбачити перебіг реакцій у часі і також визначити оптимальні умови перебігу кожного конкретного процесу в потрібному напрямку.
Перераховані теоретичні питання завжди знаходять конкретне застосування в технології.
З назви “Фізична хімія” випливає, що ця наука перебуває на межі фізики та хімії, причому вони часто в ній переплітаються. Сучасна фізична хімія являє собою широку галузь знань, з якої, в свою чергу, виділилися такі науки, як колоїдна хімія, електрохімія, фотохімія, хімічна кінетика тощо. Хімічні реакції пов’язані з різноманітними процесами: теплообміном, поглинанням або виділенням теплоти, випромінюванням світла, електричними явищами, зміною об’єму. В хімічних реакціях тісно пов’язані між собою фізичні та хімічні явища; вивчення цього взаємозв’язку – головна задача фізичної хімії. Головна увага в фізичній хімії приділяється дослідженню законів протікання хімічних процесів, стану хімічної рівноваги, вивченню властивостей розчинів. На підставі законів фізичної хімії можна вирішити одну із найважливіших задач – передбачити можливість протікання хімічного процесу, його хід і кінцевий результат.
Фізична хімія це не тільки теоретична дисципліна. Вона має не лише теоретичне, а й практичне значення. Фізична і колоїдна хімія – це базова дисципліна, яка визначає становлення висококваліфікованого спеціаліста-технолога харчової та переробної промисловості напрямку «Харчова технологія та інженерія».
Законам фізичної хімії підпорядковується більшість технологічних процесів харчової промисловості – сушка, дроблення, адсорбція,
розчинення, дистиляція, екстрагування, кристалізація, випаровування тощо. Всі біохімічні процеси, які лежать в основі багатьох харчових виробництв, також підпорядковуються законам фізичної хімії. На методах фізичної хімії заснований і технологічний контроль харчових виробництв: визначення кислотності, вологості, вмісту жирів, білків, вітамінів тощо.
|
|
|
Закони фізичної і колоїдної хімії лежать в основі заходів по охороні оточуючого середовища.
ТЕМА 1.1.
ОСНОВИ ХІМІЧНОЇ ТЕРМОДИНАМІКИ
1. Зміст та основні поняття термодинаміки.
2. Перше начало термодинаміки. Ентальпія.
3. Закон Гесса. Наслідки закону Гесса.
4. Друге начало термодинаміки.
5. Термодинамічні потенціали і фактори.
6. Розрахунок термодинамічних потенціалів в хімічних реакціях.
ВИВЧИВШИ ТЕМУ, ВИ ПОВИННІ:
Знати:
P визначення термодинаміки;
P основні поняття термодинаміки;
P перший і другий закони термодинаміки;
P закон Гесса та наслідки з нього;
P поняття ентальпії;
P поняття ентропії;
P визначення калорійності харчових продуктів
Вміти:
P розраховувати термодинамічні потенціали в хімічних реакціях;
P визначати ентальпію реакції;
P визначати зміну ентропії реакції.
1. ЗМІСТ ТА ОСНОВНІ ПОНЯТТЯ ТЕРМОДИНАМІКИ
Залежно від поставлених завдань розрізняють термодинаміку загальну, технічну та хімічну. Термодинаміка вивчає хімічні та фізичні процеси на основі енергетичних явищ, які супроводжують ці процеси, і не торкається механізмів реакцій, тобто вона вивчає лише сумарні результати реакції залежно від заданих умов.
Усі процеси, що відбуваються в природі, супроводжуються перетворенням енергії. Та область термодинаміки, що займається вивченням енергетичних змін в хімічних реакціях, називається хімічною термодинамікою.
Хімічна термодинаміка, як і загальна, ґрунтується на трьох законах (началах). Означені закони виведені на основі багатовікового досвіду і теоретично не обґрунтовуються. Правильність цих законів підтверджується тим, що у практичній діяльності людина не спостерігає явищ, які б суперечили цим законам. Знаючи закони хімічної термодинаміки, можна передбачити, чи можлива певна реакція за цих умов або за яких умов вона стане можливою, який вихід продуктів реакцій очікувати, яким тепловим ефектом вона супроводжуватиметься. При викладенні основних положень термодинаміки користуються певними поняттями.
Система – це тіло або сукупність тіл, що знаходяться у взаємодії і фактично або умовно виділені з навколишнього середовища.
Головною умовою має бути те, що система складається з великої кількості частинок (атомів, молекул). Звичайно система відокремлена від навколишнього середовища поверхнею поділу. Системою може бути окреме тіло, розчин, газ в балоні, речовина в склянці.
У залежності від того, чи буде система обмінюватись енергією та речовиною, системи поділяються на відкриті, закриті, ізольовані.
Ізольованою є система, яка не обмінюється речовиною або енергією з навколишнім середовищем і має сталий об’єм (V=const). Наприклад, запаяна ампула, що знаходиться в термосі.
Закритою є система, яка не може обмінюватися масою, але обмінюється енергією з навколишнім середовищем (газ у балоні). Наприклад, речовина, що запаяна в ампулі, може отримувати або віддавати енергію, але обмін речовиною з навколишнім середовищем не відбувається.
Відкритою називають систему, з якої безперервно відводяться продукти реакції та проводяться вихідні речовини. Наприклад, колба з киплячою водою обмінюється з навколишнім середовищем речовиною (Н2О) та енергією у вигляді теплоти (Q)
Фазою називають сукупність усіх однорідних частинок, що мають однакові властивості і відокремлені від інших частин системи поверхнею поділу.
Система може складатися із речовини в однаковій фазі, або із речовин, що відокремлені одна від одної поверхнею розділу фаз. В залежності від цього системи бувають однорідні (гомогенні) та неоднорідні (гетерогенні).
Гомогенна система складається лише з однієї фази, наприклад, повітря, розчин цукру або солі у воді. Тут між складовими частинами системи не існує поверхні розподілу.
Гетерогенною називають систему, що складається з двох або більшої кількості фаз. Таку систему ще називають неоднорідною різнофазною. Наприклад, розчин з осадом на дні, лід і вода тощо.
Фізичні величини, які виражають стан системи, називають параметрами стану. Основними параметрами є об’єм, тиск, температура, концентрація. Сукупність термодинамічних параметрів визначає стан системи. Якщо термодинамічні параметри з часом не змінюються, то система перебуває у рівноважному стані, а параметри називають рівноважними.
Параметри, які залежать від основних, змінюються лише залежно від початкового та кінцевого станів і не залежать від напряму процесу, називають функціями стану. Функціями стану є тиск (Р), об’єм (V), температура (Т), внутрішня енергія (U) тощо.
Зміну стану системи з часом називають процесом. Під час будь-якого процесу одні параметри залишаються незмінними, інші змінюються. Залежно від того, які параметри під час переходу системи з одного стану в інший залишаються сталими, процеси поділяють на ізохорні (V = const), ізобарні (P= const) та ізотермічні (T= const).
Адіабатний процес відбувається без теплового обміну з навколишнім середовищем.
Якщо в системі відбулися зміни, які привели її у вихідний стан, то кажуть, що система здійснила круговий процес, або цикл.
Оборотними є процеси, які можна здійснити в прямому та зворотному напрямах через ті самі стадії. Процеси, для яких такі переходи неможливі, називають необоротними.
2. ПЕРШЕ НАЧАЛО ТЕРМОДИНАМІКИ. ЕНТАЛЬПІЯ
Перший закон термодинаміки є наслідком закону збереження енергії, який в загальному вигляді був сформульований в середині ХVІІ ст. М.В.Ломоносовим. За цим законом в усіх явищах природи енергія не може зникнути безслідно або виникнути з нічого. Енергія може тільки перетворюватися з однієї форми в іншу в строго еквівалентних співвідношеннях. Цей закон є універсальним і підтверджується всім досвідом людства, це є найбільше відкриття ХІХ сторіччя.
Д.Бернал так охарактеризував його значення: «Він об’єднав багато наук і знаходився у винятковій гармонії з тенденціями часу....Вся людська діяльність у цілому – промисловість, транспорт, освітлення і, у кінцевому рахунку, харчування і саме життя – розглядалося з погляду залежності від цього одного загального терміна – енергія».
Перший закон термодинаміки розглядається як постулат, оскільки він не може бути виведений або доказаний яким-небудь логічним шляхом. Зміст І закону термодинаміки витікає із узагальнення багаторічного досвіду, що був накопичений людством унаслідок практичної діяльності. У наш час його справедливість визнана всіма вченими в галузі природничих наук, оскільки ні один із наслідків, до яких воно призводить, не знаходиться в суперечці з дослідом.
В загальній формі цей закон формулюється так: «В термодинамічних процесах різні форми енергії можуть переходити одна в одну в строго еквівалентних співвідношеннях, але при цьому енергія не витрачається і не створюється знову. Загальна енергія ізольованої системи залишається сталою, незалежно від змін, які відбуваються в цій системі»
Цей закон був вперше сформульований М.В.Ломоносовим у 1748 році як закон збереження руху. Після його смерті закон був забутий і повернутий в науку лише в 40-х роках ХІХ ст. працями Ю.Мейєра, Дж.Джоуля, Р.Клаузіуса і Гельмгольца, які дістали експериментальне підтвердження і конкретизацію даного закону.
Кожна система характеризується внутрішньою енергією U, яка
включає всі види енергії - енергію поступального та коливального рухів молекул, атомів, електронів; енергію їх взаємодії тощо, за винятком потенціальної енергії, що обумовлена положенням системи в просторі, і кінетичної енергії системи як цілого.
Обчислити абсолютне значення внутрішньої енергії системи неможливо. Обчислюють лише зміну внутрішньої енергії при переході системи з одного стану в інший.
Внутрішня енергія – це енергія, яка у прихованій формі знаходиться в кожному тілі. З підвищенням температури внутрішня енергія системи зростає.
Отже, неможливо створити пристрій (вічний двигун), який виконував би роботу без підведення енергії. Адже при цьому запас внутрішньої енергії системи мусив би зменшуватися. Якщо ж система обмінюється теплом з навколишнім середовищем, то зміна її внутрішньої енергії в процесі рівна різниці притоку теплоти (ΔQ) і виконаної системою роботи (А):
ΔU = ΔQ – A (1.1)
Або ΔQ = ΔU + А, (1.2)
Тобто, теплота, підведена до системи, тратиться на зміну її внутрішньої енергії (нагрів) і на виконання системою якоїсь роботи.
Дані рівняння є математичним виразом першого закону термодинаміки.
У будь-якому процесі збільшення внутрішньої енергії певної системи Δ U дорівнює наданій цій системі теплоті Q мінус кількість роботи А, яку виконала система.
Як приклад простої термодинамічної системи розглянемо газ, що знаходиться в циліндрі з поршнем (рис.1).
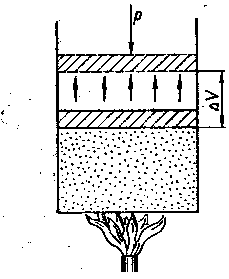 При підведенні до нього теплоти Q газ нагрівається (збільшується його внутрішня енергія U) і розширюється (виконується робота А). Таким чином, теплота Q витрачається частково на збільшення внутрішньої енергії ΔU і частково на здійснення роботи А проти зовнішніх сил:
При підведенні до нього теплоти Q газ нагрівається (збільшується його внутрішня енергія U) і розширюється (виконується робота А). Таким чином, теплота Q витрачається частково на збільшення внутрішньої енергії ΔU і частково на здійснення роботи А проти зовнішніх сил:
Q = ΔU + А
Для процесів, в яких здійснюється тільки робота розширення газу при постійному тиску: А = р (V2 - V1)
Рис.1. Схема розширення газу в циліндрі
Рівняння першого начала термодинаміки матиме наступний вигляд:
Qp = Δ U + p (V2 - V1) Qp = U2 - U1 + pV2 - pV1 (1.3)
Звідки:
Qp = (U2 + рV2) - (U1 + рV1)
Це означає, що теплота процесу при постійному тиску дорівнює різниці функції, що має вигляд:
U + pV = H (1.4)
Qp = H2 - H1 = Δ H (1.5)
Функцію Н називають ентальпією.
Ентальпія Н – це енергія, якою володіє система при сталому тиску.
Тепловий ефект реакції ΔН – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах.
ΔН = ΔН1 – ΔН2
Так як тиск Р і об’єм V – параметри стану, а U – функція параметрів стану, то й ентальпія Н також є функцією стану, тобто її зміна не залежить від напряму процесу, а визначається лише початковим і кінцевим станом системи.
З рівняння (1.5) видно, що теплота, яка поглинається системою при постійному тиску Р, дорівнює приросту ентальпії ΔН.
Якщо процес протікає без зміни об’єму V, тобто V2 - V1 = 0, то з рівняння (1.3) одержимо:
Qv = U2 - U1 = Δ U (1.6)
Різниця між величинами ΔU і ΔН досить велика для систем, що містять речовини в газоподібному стані. Якщо нагрівати газ при постійному об’ємі V, то вся теплота буде йти на збільшення внутрішньої енергії ΔU.
При нагріванні газу такою самою кількістю теплоти при постійному тиску Р він буде розширятися, витрачаючи частину теплоти Q на роботу розширення А. Тому зміна ентальпії буде включати в себе і зміну внутрішньої енергії ΔU, і ту кількість теплоти, яка пішла на розширення рΔV.
Для систем, речовини яких знаходяться в рідкому або кристалічному стані, в звичайних умовах різницею в величинах ΔU і ΔН можна знехтувати, бо об’єм рідин і твердих тіл при нагріванні змінюється незначно.
Хімічні реакції і фізико-хімічні процеси можуть відбуватися з виділенням або поглинанням енергії.
Термохімія – це розділ фізичної хімії, який вивчає теплові ефекти хімічних реакцій.
Процеси, в яких теплота виділяється, називаються екзотермічними. Зрозуміло, якщо реакція екзотермічна (ΔН<0), то вміст енергії у вихідних речовинах більший, ніж у продуктах реакції.
Процеси, що протікають з поглинанням теплоти – ендотермічні. Речовини, які вступають у реакції при ендотермічних процесах, будуть мати більший запас енергії у порівнянні з вихідними речовинами.
Кількість теплоти, що виділяється або поглинається при реакції, називається тепловим ефектом реакції. Якщо реакція протікає при постійному об’ємі, то згідно з рівняннм (1.6) тепловий ефект реакції:
Qv = Δ U
Якщо реакція протікає при постійному тиску Р, то відповідно до рівняння (1.5) тепловий ефект реакції Qp = ΔН.
Для різних розрахунків в термохімії користуються не хімічними рівняннями, а термохімічними.
Термохімічні рівняння – це запис рівняння хімічної реакції із зазначенням теплового ефекту.
В термохімічних рівняннях вказують абсолютну величину і знак теплового ефекту реакції, який відноситься до одного молю вихідних речовин або продуктів реакції. Тому в термохімічних реакціях можуть бути дробові стехіометричні коефіцієнти. В цих рівняннях відмічають також агрегатний стан кожної речовини (г – газоподібне, р – рідке, т – тверде, к – кристалічне), а інколи їх алотропну форму (графіт, алмаз).
Основним законом термохімії є закон Германа Г есса (російський вчений), який встановлює, що:
тепловий ефект реакції залежить тільки від вигляду і стану початкових і кінцевих продуктів, але не залежить від проміжних станів та шляхів переходу початкових речовин до кінцевих.
Закон Гесса є окремим випадком першого закону термодинаміки, що застосовується до хімічних процесів, які протікають в ізохорних або ізобарних умовах.
Як приклад, що підтверджує закон Гесса, розглянемо реакцію утворення діоксиду карбону. Він утворюється при безпосередньому спалюванні вугілля (графіту), але можна також провести процес в дві стадії, одержуючи на першій з них СО і, спалюючи його на другій стадії до СО2.
С (графіт) + О2 (г) = СО2 (г); ΔН1
С (графіт) + 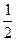 О2 (г) = СО(г) ; ΔН2
О2 (г) = СО(г) ; ΔН2
СО(г) + 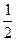 О2 (г) = СО2(г) ; ΔН3
О2 (г) = СО2(г) ; ΔН3
Закон Гесса дозволяє зв’язати теплові ефекти цих трьох процесів рівнянням:
ΔН1 = ΔН2 + ΔН3
Якщо два з цих теплових ефектів відомі, то легко розрахувати й третій.
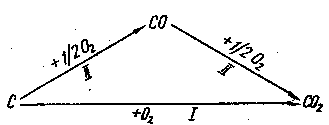
Рис. 2. Схема процесів до закону Гесса.
З цього можна зробити висновок, що згідно із законом Гесса, незалежно від того, яким шляхом ми здобули карбон (ІV) оксид (СО2) – сумарний тепловий ефект буде однаковий (рис.2).
Користуючись законом Гесса, можна розрахувати теплові ефекти таких реакцій, які або важко реалізувати, або неможливо довести до кінця, або ж зовсім для нових процесів, які ще не відбувалися. Цей закон можна застосувати як до хімічних реакцій, так і до процесів розчинення, випаровування, кристалізації, адсорбції.
Наслідки закону Гесса
1. Тепловий ефект хімічної реакції дорівнює різниці сум теплот утворення продуктів реакції і теплот утворення вихідних речовин. Наприклад, тепловий ефект ΔН° реакції:
НСl + NНз = NН4Сl
у газовій фазі дорівнює:
ΔН° =ΔНутв,(NН4СІ) – ΔНоутв(НСІ) – ΔНоутв(NН3).
2. Тепловий ефект хімічної реакції дорівнює різниці сум теплот згоряння вихідних речовин і теплот згоряння продуктів реакції. Наприклад, тепловий ефект ΔН° реакції:
СН4 + СО2 = 2СО +2Н2
у газовій фазі дорівнює:
ΔН° =ΔНозгор.(СН4) - 2ΔН°згор.(СО) - 2ΔН°згор.(Н2)
З. Якщо здійснюються дві реакції, які приводять системи з різних початкових станів в однакові кінцеві, то різниця теплових ефектів цих реакцій дорівнює тепловому ефекту переходу з одного початкового стану в інший.
Наприклад:
С графіт + О2 = СО2; ΔН° = - 393,51 кДж/ моль;
С алмаз + О2 = СО2; ΔН° = - 395,54 кДж/ моль;
С графіт → С алмаз Δ Н° = -393,51 - (- 395,54) = 1,83 кДж/моль.
4. Якщо здійснюються дві реакції, які приводять системи з однакових початкових станів до різних кінцевих, то різниця теплових ефектів цих реакцій дорівнює тепловому ефекту переходу з одного кінцевого стану до іншого.
Наприклад:
Н2 + 1/2О2 = Н2О р; ΔН° = -285,84 кДж/моль:
Н2 + 1/2О2 = Н2О г; ΔНо = -271,83 кДж/ моль;
Н2О р →Н2О г; ΔН° = - 271,83 - (- 285,84) = 44,01 кДж/моль.
Організм людини можна розглядати як унікальний хімічний реактор, в якому відбувається велика кількість різноманітних хімічних перетворень.
Основним джерелом енергії для живих організмів є хімічна енергія, що міститься в продуктах харчування. Для людини головними компонентами їжі є жири, білки, вуглеводи, при окисненні яких виділяється енергія. Реакції в організмі за участю речовин, спожитих із їжею, переважно екзотермічні, тобто відбуваються з виділенням теплоти. Більшість цих перетворень певною мірою нагадує реакції горіння. (Іноді, наприклад, говорять про «згоряння жирів в організмі».)
Кількість енергії, що виділяється під час повного окиснення харчового продукту, визначає калорійність продукту. Вивільнена теплова енергія потрібна живому організму для здійснення в ньому реакцій, що відбуваються з поглинанням теплоти, а також для підтримання постійної температури тіла. Енергетичну характеристику продуктів харчування прийнято подавати у калоріях. Їжа найчастіше є сумішшю поживних речовин різного складу, тому калорійність їжі вказують у розрахунку на 1г, а не на 1 моль. При цьому слід пам'ятати, що 1 калорія = 4,18 Дж.
Калорійністю харчових речовин називається енергія, що виділяється при повному окисненні (згоранні) 1г поживних речовин.
Існують три основні групи поживних речовин у харчових продуктах: жири, білки і вуглеводи. Вони окислюються в організмі до тих же продуктів, що і при згорянні в калориметрі.
С→СО2
Н→Н2О
N→N2
Тому для енергетичної оцінки більшості продуктів харчування може служити ентальпія реакції їх згоряння.
Найбільшу енергетичну цінність мають жири, при окисненні яких виділяється 37,7 - 39,8 кДж/г (9 - 9,5 ккал/г). У процесі засвоєння вуглеводів виділяється 16,5 - 17,2 кДж/моль 4- 4,1 ккал/г. На тому ж рівні і енергетична цінність білків. Якщо олія складається практично із жирів, цукор – чистий вуглевод, то 100%-ої білкової їжі не існує. Найбільше білків міститься у м’ясі, рибі, сирі, горіхах (10-25% від маси продукту). Білки – найцінніший «будівельний» матеріал для організму, а вуглеводи й особливо жири важливі як джерела енергії.
Для дорослої людини норма вживання поживних речовин на добу становить12000кДж, а саме: жирів 60-70г, білків 80-100г (при важкій праці 130 - 140г), потрібна маса вуглеводів повинна в 4-5 разів перевищувати масу білків, причому, тільки невелика частина від цього повинна бути у вигляді сахарози (приблизно 8г).
Кількість енергії, що витрачається людиною, залежить від віку, статі та інтенсивності праці. Підрахувати, скільки людина має споживати білків, жирів, вуглеводів, певних харчових продуктів, щоб забезпечити свій організм необхідною кількістю енергії, неважко.
Таблиця 1.1.
Кількість енергії, що витрачається різними категоріями людей
| Вид діяльності | Кількість енергії | |
| кДж | ккал | |
| Легка праця, сидячі (канцелярські) працівники | 8400-11700 | 2000-2800 |
| Помірна напруженість (студенти, лікарі, учні) | 12500 - 15100 | 3000-3600 |
| Важка фізична праця (ливарники, ковалі) | 167000-20900 | 4000-5000 |
| Особливо важка праця (землероби, спортсмени) | до 30100 | до 7200 |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1162; Нарушение авторских прав?; Мы поможем в написании вашей работы!