
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вплив тиску 2 страница
|
|
|
|
Гетерогенний каталіз – це вид каталізу, в якому каталізатор знаходиться в іншій фазі ніж реагенти.
Найчастіше каталізатор перебуває в твердому стані, а реагенти і продукти реакції – в рідкому або газоподібному.
Швидкість гетерогенної каталітичної реакції залежить від реагуючої поверхні каталізатора, бо усі реакції за гетерогенного каталізу протікають на його поверхні. Встановлено, що каталітичну активність має не вся поверхня каталізатора, а тільки її певні ділянки – активні центри. Активними центрами можуть бути фізичні неоднорідності на поверхні каталізатора. Можуть бути також атоми, що мають ненасичені валентності і, завдяки чому, вони можуть утворювати нестійкі поверхневі проміжні сполуки з речовинами рідкої або газоподібної фази.
Наявність активних центрів на поверхні каталізатора підтверджується високою чутливістю каталізатору до дії каталітичних отрут.
Каталітичні отрути – речовини, що знижують каталітичну активність каталізатора.
Дія каталітичних отрут пояснюється тим, що молекули цієї речовини накопичуються на активних центрах, блокують їх і виводять їх із участі в реакції. Так як активні центри займають невелику частину поверхні, то для їх «отруєння» достатньо невеликої кількості каталітичної отрути.
При збільшенні неоднорідності поверхні збільшується активність каталізатору. Це досягається збільшенням дисперсності або введенням в каталізатор деяких речовин, які самі не є каталізаторами, але змінюють структуру поверхні, збільшуючи активність каталізаторів. Такі речовини називають промоторами.
На активність і селективність каталізатору впливає природа матеріалу, на який він нанесений (носія). Один і той самий каталізатор, нанесений на різні носії, каталізує реакції різних типів. Це пояснюється різною будовою активних центрів каталізатора, в залежності від природи носія, і будовою його поверхні.
|
|
|
Весь каталітичний процес, що відбувається на твердому каталізаторі, можна розбити на п’ять послідовно протікаючих стадій:
¨ Дифузія молекул вихідних речовин до поверхні каталізатора.
¨ Адсорбція вихідних речовин на активних центрах за рахунок хімічних і електричних сил.
¨ Хімічна взаємодія адсорбованих речовин з утворенням продуктів реакцій.
¨ Десорбція продуктів з поверхні каталізатора.
¨ Дифузія продуктів у глибину фази.
Перша і остання стадії називаються дифузійними, решта – кінетичними. Всі ці стадії можуть відбуватися з різними швидкостями і швидкість всього каталітичного процесу визначається (лімітується) його найбільш повільною стадією. Слід зазначити, що каталізатори мають специфічну дію, тобто кожний хімічний процес може прискорюватись або сповільнюватись тільки певним каталізатором.
Наприклад, при пропусканні парів етанолу при 300-4000С над мідним каталізатором відбувається дегідрування спирту з утворенням етаналю:
Cu
С2Н5ОН → СН3СОН + Н2
Якщо каталізатором є алюміній оксид, то відбувається дегідратація спирту з утворенням етилену:
Al2O3
С2Н5ОН → С2Н4 + Н2О
Взагалі, слід відзначити, що в практиці рідко застосовуються каталізатори, до складу яких входить лише одна речовина. У переважній більшості промислових процесів доводиться застосовувати складні багатокомпонентні системи, які мають достатню активністю і селективність. Компоненти таких складних каталізаторів можуть утворювати хімічні сполуки, тверді розчини чи знаходитись у вигляді суміші окремих фаз.
- ФЕРМЕНТАТИВНИЙ КАТАЛІЗ
Каталіз відіграє винятково важливу роль у живій природі. Практично всі біохімічні реакції протікають за участю біологічних каталізаторів – ензимів, або ферментів.
|
|
|
Ферменти – біологічні каталізатори білкової природи.
Ферментативний каталіз – це процес прискорення біохімічних процесів за допомогою ферментів.
Будь-який фермент, що утворюється в рослинних і тваринних організмах, є складною сполукою білкової природи з відносною молекулярною масою до 500000 – 700000. Кожен фермент має одну або декілька активних груп.
Активна група – це складна елементоорганічна сполука, до складу якої як центральний комплексоутворювач входять Fe, Cu, Zn, Mo, Mn чи атом іншого елемента.
Усі ці елементи називають мікроелементами. Вони необхідні для живлення рослин та людського організму. Хімічна будова ряду активних груп зараз вже розкрита, деякі з них навіть вдалося синтезувати. Але активність таких штучних груп ще в сотні разів менша, ніж у природних ферментів. Отже, білкова частина ферменту також суттєво впливає на активність ферменту. З викладеного ясно, що ферменти можна віднести до гомогенних металокомплексних каталізаторів.
Ферменти існують у всіх живих клітинах і поділяються на прості і складні.
 ФЕРМЕНТИ ФЕРМЕНТИ
|

| Прості Складаються тільки з білка | Складні Складаються із білка і небілкової частини - кофермента |
Ферменти відрізняються високою каталітичною активністю, специфічністю дії та селективністю.
Ферменти в порівнянні з неорганічними каталізаторами, дуже специфічні. Наприклад, амілаза, яку містить слина, легко і швидко розщеплює крохмаль, але не каталізує процес розпаду інших вуглеводів. Уреаза виключно ефективно каталізує гідроліз сечовини, але не впливає на її похідні. Така особливість ферментів дозволяє живим організмам, маючи необхідний набір ферментів, активно реагувати на зовнішню дію.
Інша особливість ферментів – підвищена чутливість їх каталітичної активності до рН середовища. Це свідчить про важливу роль кислотно-основних реакцій в біокаталізі.
Ферменти руйнуються і втрачають свою активність у процесі роботи значно швидше, ніж звичайні каталізатори. Помічено, що чим активніший фермент, тим швидше він інактивується. Крім того, ферменти дуже легко отруюються багатьма речовинами.
|
|
|
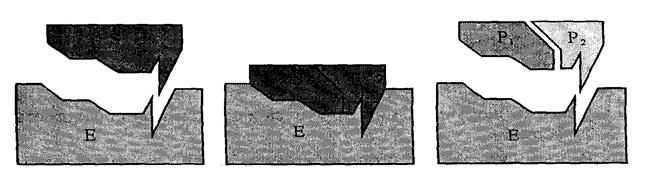 Механізм дії ферментів дуже складний і вивчений ще недостатньо. Його можна пояснити спрощеною геометричною моделлю, відомою під назвою «ключа і замка».
Механізм дії ферментів дуже складний і вивчений ще недостатньо. Його можна пояснити спрощеною геометричною моделлю, відомою під назвою «ключа і замка».
Рис.18. Модель “ключа і замка”, що пояснює утворення комплексі фермент-субстант.
З рисунку 18 видно, що форма молекул вихідних речовин (субстрату) відповідає структурі активного центру молекули ферменту Е утворюється перехідний комплекс з участю ферменту, проходить каталітична реакція, і продукт реакції S (темніший елемент) десорбується з ферменту. Молекули субстрату при наближенні до активного центру якимось чином активуються і стають здатними до надзвичайно швидкої реакції. Активація здійснюється в результаті перерозподілу електронних густин певних хімічних зв’язків під дією ферменту. Крім того, у процесі входження в активний центр молекула субстрату відповідно деформується і стає більш реакційноздатною.
Ферментативний каталіз – основа життєдіяльності всіх живих організмів. До хімічних функцій живих клітин входить розклад і синтез білків, жирів, вуглеводів і інших складних речовин. Завдяки високій специфічності і активності ферментів, за стислий час і при низьких температурах у живому організмі утворюються сполуки, необхідні для його життєдіяльності.
Ферменти з давніх-давен використовуються людиною. Велике значення має ферментативний каталіз у харчовій технології. Процеси випікання хліба, приготування кисло-молочних продуктів і сирів, виготовлення вина і пива, квашення овочів, ягід і фруктів і навіть дублення шкіри – далеко не повний перелік використання ферментів. Відомо, що одним із основних процесів виготовлення хліба є дріжджове бродіння тіста. Вуглеводи, що містить борошно, під дією дріжджів перетворюються на карбон (ІV) оксид і етанол:
дріжджі
С6Н12О6 → 2СО2↑ + 2С2Н5ОН
Вміст ди- і моносахаридів у борошні невеликий, вони не забезпечують інтенсивного газоутворення. Але борошно містить ферменти амілази, які розщеплюють крохмаль. У процесі бродіння тіста вони підтримують необхідну концентрацію моно- і дисахаридів.
|
|
|
У виробництві плодово-ягідних соків пектолітичні ферменти застосовують для підвищення виходу соку, його освітлення і стабілізації. Завдяки біотехнологіям мікробіологічного синтезу ферменти стали більш доступними. Це дає можливість застосовувати їх у харчовій промисловості, медицині. Їх також додають у синтетичні миючі засоби.
!ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Задача 24
Як зміниться швидкість прямої і зворотної реакції, якщо збільшиться тиск в 3 рази?
N2 + 3H2↔2NH3
Розв'язання.
Запишемо за законом діючих мас вирази для швидкостей прямої і зворотної реакції.
Vnp = k[N2][H2]3
Vзв = k [NH3]2
Якщо збільшити тиск в 3 рази, то об'єм газової суміші зменшиться в 3 рази, а мольні концентрації даних речовин в цьому об'ємі збільшаться в 3 рази.
При збільшенні тиску в 3 рази вони стануть 3[N2], 3[Н2] і 3[NН3]. Запишемо вираз для швидкості прямої і зворотної реакції після збільшення тиску
V'пр = k 3[N2](3[H2])3 = k 81[N2][H2]
V'зв = k (3[NH3])2 = 9 k [NH3]2
V′np/Vnp = 81; V′зв / Vзв = 9
Отже, при збільшенні тиску в 3 рази швидкість прямої реакції збільшиться в 81 раз, а швидкість зворотної реакції в 9 раз.
Задача 25
Період напіврозпаду (Á) полонію дорівнює 137 діб. Знайти час, протягом якого від вихідної кількості речовини - 0,1г – залишиться 0,01г (10%).
Розв’язання.
Радіоактивний розпад описується кінетичним рівнянням реакцій першого порядку тобто  = - К ·х, або КХ = ℓn
= - К ·х, або КХ = ℓn 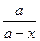 ,
,
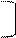
 або: Кt =2,3ℓq
або: Кt =2,3ℓq 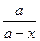 , де
, де
к- константа швидкості;
t- час реакції;
α - початкова концентрація або кількість речовини;
х - поточна концентрація, кількість, що прореагувала.
(α-х) - кінцева концентрація.
Крім того, константа швидкості пов’язана з періодом напіврозпаду співвідношенням
К = 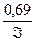 .
.
Звідси t 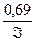 = 2,3 ℓg
= 2,3 ℓg 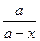
Підставимо дані задачі в одержане рівняння:
 t = 2,3 · ℓg
t = 2,3 · ℓg 
 t = 2,3 · ℓg 10 = 2,3 ·1
t = 2,3 · ℓg 10 = 2,3 ·1
t = 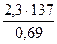 = 4,57 · 102 (діб)
= 4,57 · 102 (діб)
Задача 26
Визначте енергію активації реакції розкладання йодистого водню, якщо відомо, що константа швидкості
К Т1 = 8,1· 10-5 (Т1 = 629К) і К Т2 = 1,06· 10-1 (Т2 = 781 К)
Розв’язання.
Залежність константи швидкості від енергії активації визначається рівнянням:
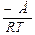
К = К0 ·ℓ або ℓnК = ℓnК0 - 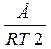 ,
,
де: К - константа швидкості при даній температурі Т;
Ко- константа;
R- універсальна газова стала;
ℓ- основа натуральних логарифмів;
Е- енергія активації.
Використовуючи дані задачі, маємо два рівняння:


К1 = Ко ·ℓ; К2 = Ко ·ℓ
Або в логарифмічній формі:
ℓnК1, = ℓnКо - 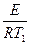 (1); ℓnК2 = ℓnКо -
(1); ℓnК2 = ℓnКо - 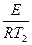 (2)
(2)
Віднімемо з рівняння (1) рівняння (2)
ℓnК1 - ℓnК2 = 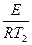 -
- 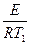
ℓn  = Е (
= Е (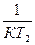 -
- 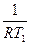 )
)
Звідси: 2,3 ℓg  = Е (
= Е (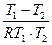 )
)
Е = 2,3 ℓg  : (
: (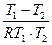 )
)
Підставимо дані задачі та R= 8,313 
Е =  ℓg
ℓg 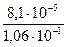 =192,8
=192,8 
САМОСТІЙНА РОБОТА
@Задача 27
Знайти кількість речовини, що залишилася після протікання реакції, або час реакції за даними таблиці.
| № варіанту | Процес | Порядок реакції | Період напіврозпаду | Час протікання Реакції, с | Початкова концентрація (к-сть) | Кінцева концентрація (к-сть) | Константа швидкості |
| Розпад ізотопу 97 Тh | I | 44C | 1г | ||||
| СН3NH2 = HCN + 2H2 | I | 0,001 
| (T= 913К) 5.0 ∙10-3 | ||||
N2O5 = N2O4 + 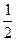 O2 O2
| I | 0,1 | 7,9·10-7 (Т=273К) | ||||
| Розпад ізотопу | I | 10 діб | 10г | 0,1г | |||
  НСООН НСООН 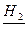  
| I | 10-2 
| 3,44· 10-3 | ||||
| 2F2O = 2F + O2 | I | 10-4 
| 1,04· 10-4 | ||||
| Розпад ізотопу | I | 100 діб | 100г | 0,1г | |||
 СН3СООС2Н5 СН3СООН + С2Н5ОН СН3СООС2Н5 СН3СООН + С2Н5ОН
| ІІ | 0,16 | 0,007 | ||||
| Розпад ізотопу | ІІ | 300 діб | 100г | 100г | |||
| Розпад ізотопу | ІІ | 100% | 90% | 4 ·10-1 |
@Задача 28
Розрахуйте енергію активації процесу за даними таблиці.
| № Ва- ріан ту | Початкова темпе- ратура, Т1 ,К | Кінцева темпе- ратура Т2 ,К | Кон- станта швид- кості при Т1 | Кон- станта швид- кості при Т2 | Процес |
| 83,9 | 2NO2= 2NO + O2 | ||||
| 2,5 · 10-4 | 7,0· 10-3 | 2HI=H2+I | |||
| 0,02 | 0,60 | ||||
| 0,5· 10-5 | 1,6 ·10-3 | CCI3COOH=CO2+CHCI3 |
!ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Фотохімічні реакції.
Задача 29
За результатами аналізу встановлено, що цукровий буряк на 1га в день дає прибавку біомаси 80кг. Рахуючи, що в цій кількості 30% карбону, розрахуйте скільки літрів СО2 засвоєно рослиною і скільки кисню при цьому виділено?
Розв’язання.
Задача розв’язується, якщо передбачити, що весь карбон поступає в рослину при фотосинтезі:
6СО2 + 6Н2О = С6Н12О6 + 6О2
Розрахуємо, скільки карбону поглинулося.
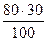 = 24 кг
= 24 кг
Враховуючи, що 1 кмоль складає 12 к С, то 2 кмоля – 24 кг. З рівняння фотосинтезу випливає, що 6кмоль СО2 і при його асиміляції виділяється в кмоль О2. Якщо у нас є 2 кмоля С, отже стільки ж кмолей О2 і СО2.
З закону Авогадро випливає, що 1 кмоль газу займає об’єм 22,4м3.
Таким чином, було поглинуто 22,4 х 2 = 44,8м3 СО2 і виділилося 44,8 м3СО2
Задача 30
Розрахуйте об’єм кисню, що виділяється при фотосинтезі, та об’єм поглинутого вуглекислого газу, якщо дано збільшення біомаси при фотосинтезі і передбачається (спрощено),що збільшення біомаси обумовлено утворенням глюкози.
| № варіанту | Збільшення біомаси на 1га/ добу, кг | % сухої речовини в біомасі |
& ТИМ, ХТО ХОЧЕ ЗНАТИ БІЛЬШЕ
ВПЛИВ ТЕМПЕРАТУРИ НА ШВИДКІСТЬ БІОЛОГІЧНИХ ПРОЦЕСІВ
Характер впливу температури на інтенсивність біологічних процесів досить складний і зумовлений тим, що живі організми можуть існувати лише в певному температурному інтервалі. Для кожного виду організмів цей інтервал строго визначений, але у більшості випадків життєдіяльність можлива при 274-318К. Проте деякі організми можуть існувати як при вищих, так і при нижчих температурах. Найбільш жаростійкі організми є серед бактерій. Деякі з них витримують нагрів більше 343К і гинуть лише при кип’ятінні, а окремі види бактерій витримують нагрів вище 373К. Інтенсивність біологічних процесів значною мірою визначається швидкістю хімічних реакцій, що лежать в їх основі. На кривій залежності інтенсивності біологічних процесів від температури можна встановити три характерні точки: мінімальна (близько 273К), оптимальна і максимальна, яка на декілька градусів перевищує оптимальну. В інтервалі від мінімуму до максимуму залежність швидкості від температури біологічних процесів так, як і хімічних, має експоненціальний характер. Проте подальше підвищення температури призводить до значного порушення інтенсивності перебігу та злагодженості біологічних процесів аж до загибелі організмів. Останнє відбувається внаслідок температурної денатурації ферментів та інших білків. Доречно нагадати, що в клітинах організмів є набори так званих ізоферментів, які відрізняються температурними оптимумами каталізу одних і тих самих реакцій, що відіграє важливу роль для виживання цих організмів при змінах температури навколишнього середовища.
ПРО УМОВИ ЗБЕРІГАННЯ ХАРЧОВИХ ПРОДУКТІВ
Відомо, що майже кожний харчовий продукт, особливо той, який перебуває на повітрі за звичайних умов, швидко псується. Причина – взаємодія речовин, що містяться в продукті, одна з одною і з речовинами довкілля – киснем, водою тощо. Таким реакціям бажано запобігати або хоча б уповільнювати їх.
Найпростіший шлях – ізолювати продукти від навколишнього середовища. Для цього їх загортають у папір, полімерну плівку, алюмінієву фольгу, герметично упаковують, а іноді із упаковки ще й відкачують повітря.
Вам відомо, що швидкість хімічної реакції залежить від температури. У спеку вже за дві-три години їжа стає непридатною для вживання. Продукти зберігаються значно довше за низької температури, в охолодженому або
замороженому стані. Останній спосіб зберігання найчастіше використовують для м’яса, риби, деяких фруктів і ягід.
Оскільки швидкість реакції зростає зі збільшенням поверхні контакту речовин, чимало продуктів брикетують.
Більшість реакцій у неоднорідних сумішах відбувається значно повільніше, ніж в однорідних, тобто розчинах. Тому терміни зберігання сухих молочних продуктів і різних концентратів у десятки і сотні разів перевищують терміни для свіжого молока, рідких супів. Борошно і крупи зберігаються тим довше, чим менша їхня вологість.
J ТЕСТ ПО ТЕМІ 1.4. "ХІМІЧНА КІНЕТИКА І КАТАЛІЗ “
| Питання | Варіанти відповіді |
| 1. Залежність швидкості нескладних хімічних реакцій від концентрації визначається формулою: | а) V = K СnA Свm; б) V = 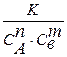 ; в)V = ; в)V =  ; г) V = K CACB. ; г) V = K CACB.
|
| 2. З підвищенням температури швидкість хімічних реакцій: | а) знижується; б) залишається сталою; в) зростає. |
| 3. Правило Вант-Гоффа: | а) "З підвищенням температури на кожні 10°С швидкість хімічної реакції збільшується в 2-4 рази"; б) "З пониженням температури на кожні 10°С швидкість хімічної реакції збільшується в 2-4 рази"; в) "З підвищенням температури на кожні 10°С швидкість хімічної реакції зменшується в 2-4 рази"; г) "З пониженням температури на кожні 10°С швидкість хімічної реакції збільшується в 2-4 рази ". |
| 4. Від яких чинників залежить швидкість хімічної реакції? | а) від природи речовин, що реагують; від агрегатного стану речовин; від площі поверхні зіткнення речовин, що реагують; від концентрації реагуючих речовин; від температури; від каталізу; б) від тиску; від агрегатного стану речовин, від концентрації реагуючих речовин, від температури; від ентальпії, від площі поверхні зіткнення речовин, що реагують; в) від концентрації реагуючих речовин; від температури, від тиску; від ентропії, від агрегатного стану речовин; г) від температури, від тиску, від об'єму реагуючих речовин, від агрегатного стану речовин, від площі поверхні зіткнення речовин, що реагують. |
| 5. Константа швидкості реакції | а) залежить від концентрації реагуючих речовин і часу; б) не залежить від концентрації реагуючих речовин і часу; в) не залежить від концентрації реагуючих речовин, але залежить від часу; г) залежить від концентрації реагуючих речовин, але не залежить від часу. |
| 6. Найпоширенішим і уні-версальним є каталізатор: | а) А12Оз; б) Сu; в) NO2; г) Н2О; д) МnО2. |
| 7. З часом активність каталізаторів: | а) зменшується; б) збільшується; в) залишається не змінною. |
| 8. Які речовини називаються промоторами? | а) це каталізатори, що змінюють структуру поверхні реагуючих речовин; б) це речовини, які не змінюючи структури поверхні, збільшують активність каталізаторів; в) це речовини, які самі не є каталізаторами, але змінюють структуру поверхні, збільшують активність каталізатора; г) це речовини, які змінюючи структуру поверхні, зменшують активність каталізатора. |
| 9. Що називають антиоксидантами? | а) каталізатори, що прискорюють процес окислення; б) інгібітори, що гальмують процес окислення; в) каталізатори, що не впливають на процес окислення. |
| 10. Із збільшенням концентрації каталізатора: | а) швидкість хімічної реакції зростає; б) швидкість хімічної реакції зменшується; в) швидкість хімічної реакції залишається незмінною. |
´Контрольні запитання
- Що вивчає хімічна кінетика?
- Що називається швидкістю хімічної реакції?
- Перелічіть фактори, що впливають на швидкість хімічної реакції.
- Опишіть вплив природи реагуючих речовин на швидкість хімічної реакції
- Сформулюйте закон діючих мас.
- Як впливає температура на швидкість хімічної реакції?
7. Що таке енергія активації?
8. Як впливає тиск на швидкість реакції?
9. Запишіть математичний вираз швидкості хімічних реакцій.
10. Як змінюється швидкість хімічних реакцій в залежності від площі стикання реагуючих речовин? Наведіть приклади.
11. Зробіть висновки про залежність швидкості хімічних реакцій від концентрації реагуючих речовин.
12. Що називають константою швидкості хімічних реакцій і від чого вона залежить?
13. Поясніть рівняння Арреніуса на основі теорії активних зіткнень.
14. Від яких чинників залежить реакційна здатність реагуючих речовин?
15. Що таке каталізатор?
16. Що таке гомогенний і гетерогенний каталіз?
17. Поясніть, у чому суть природи каталітичної дії?
18. Які особливості ферментативного каталізу?
19. Чому біокаталізатори відзначаються високою специфічністю?
20. Що називають фотохімічними реакціями?
21. У чому суть закону фотохімічної еквівалентності Ейнштейна?
22. Творче завдання: Одного разу всесвітньо відомий вчений, лауреат Нобелівської премії Лайнус Полінг звернувся до молодих аспірантів з таким запитанням:
«Якби в результаті якоїсь світової катастрофи були знищені всі наукові закони й теорії, створені вченими протягом сторіч, то який закон чи теорія лягли б в основу нових відкриттів і чому?»
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 681; Нарушение авторских прав?; Мы поможем в написании вашей работы!