
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткие сведения из термодинамики
|
|
|
|
Термодинамика изначально возникла как наука о превращении тепла в работу. Однако законы, лежащие в её основе, имеют настолько общий характер, что в настоящее время термодинамические методы применяются для исследования многих физических и химических процессов. Основу термодинамики составляют первые два начала. Первое начало устанавливает количественные соотношения, имеющие место, при превращениях энергии из одних видов в другие. Второе начало термодинамики определяет условия, при которых возможны эти превращения, то есть определяет возможные направления процессов.
Применительно к условиям работы тепловой машины первое и второе начала формулируются следующим образом [3].
Первое начало: невозможен перпетуум мобиле (вечный двигатель) пер-вого рода, то есть такой периодически действующий двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энер-гия. Работу машины, двигателя принято характеризовать коэффициентом полезного действия h, который определяется как отношение совершаемой за цикл работы W к получаемому за цикл теплу Q, то есть h=W/Q. Согласно первому началу h не может быть больше единицы.
Известны три формулировки второго начала. Первая из них: невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Здесь ключевым моментом является понятие «самопроизвольный». Поэтому не следует представлять дело так, что начало вообще запрещает переход тепла от менее нагретого тела к более нагретому. Такой переход имеет место, например, в холодильной установке, но он связан с совершением работы.
Вторая формулировка: невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определённого количества тепла и превращения этого тепла полностью в работу, например, в тепловой машине превращение тепла в работу сопровождается дополнительным процессом-передачей некоторого количества тепла более холодному телу, то есть тепловыми потерями.
|
|
|
Третья формулировка созвучна со второй: невозможен перпетуум мобиле второго рода, то есть такой периодически действующий двигатель, который получал бы тепло от одного источника и превращал это тепло полностью в работу.
В общем случае применительно к различным физическим и химическим процессам первое начало, называемое также первым законом термодинамики, записывается в виде:
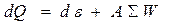 (1.1)
(1.1)
и выражает тот факт, что тепло Q, поглощаемое веществом, тратится на изменение его внутренней энергии e и совершение различного рода работ (W). Так как работа обычно определяется в Дж, то коэффициент А =  , кал/Дж (величину А называют механическим эквивалентом тепла).
, кал/Дж (величину А называют механическим эквивалентом тепла).
Внутренняя энергия вещества – это энергия движения его структурных частиц (молекул, атомов).
Как известно, между основными параметрами, определяющими состояние вещества, – массовой плотностью r, давлением Р и абсолютной температурой Т – существует однозначная взаимозависимость. Уравнение, характеризующее эту взаимосвязь, называется уравнением состояния данного вещества
F(Р,r,Т)=0 (1.2)
Вместо массовой плотности r часто пользуются величиной, ей обратной 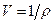 , называемой удельным объёмом.
, называемой удельным объёмом.
Внутренняя энергия вещества определяется параметрами состояния и может быть представлена в одной из следующих форм записи:
 ,
,  ,
, 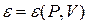
Являясь функцией основных параметров, величина внутренней энергии зависит только от начального и конечного состояния вещества. Математически этот факт характеризуется соотношением

Для получения количественных оценок величины внутренней энергии при переходе вещества из одного состояния в другое необходима конкретизация уравнения (1.2). Кроме того, важную роль играет величина удельной теплоёмкости 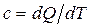 . При пожарах и взрывах рассматриваются в основном процессы, происходящие или при постоянном давлении, или постоянном объёме, которым соответствуют значения теплоёмкости
. При пожарах и взрывах рассматриваются в основном процессы, происходящие или при постоянном давлении, или постоянном объёме, которым соответствуют значения теплоёмкости  и
и 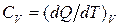 .
.
|
|
|
В кинетической теории жидкости и газа доказывается, что уравнение состояния любого вещества определяется соотношением вида [4]
 , (1.3)
, (1.3)
где первый член в правой части соотношения учитывает движение, а второй – взаимодействие частиц.
В важном частном случае, когда рассматриваемое вещество – это воздух, уравнение (1.3) может быть существенно упрощённо. Значимость этого случая обусловлена тем обстоятельством, что процессы горения и взрыва чаще всего происходят в воздушной среде.
В приближённых расчётах воздух обычно рассматривается как идеальный газ. Для идеального газа, то есть газа, силы взаимодействия между частицами которого пренебрежимо малы, функции  ,
,  . Тогда уравнение (1.3) принимает вид
. Тогда уравнение (1.3) принимает вид
 , (1.4)
, (1.4)
где R – газовая постоянная (численное значение этой величины приводится в §1.2). Уравнение (1.4) – уравнение Менделеева-Клайперона.
В термодинамических процессах воздух принимается как однородная система, состоящая из элементарных частиц, одинаковых по своим физическим и химическим свойствам. Для таких систем единственным видом работ является работа расширения (сжатия), и соотношения (1.1) принимает вид
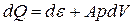 (1.5)
(1.5)
Очевидно, в случае изохорного процесса, то есть процесса, протекающего при постоянном объёме  , и всё тепло идёт на приращение внутренней энергии вещества, то есть
, и всё тепло идёт на приращение внутренней энергии вещества, то есть  . Отсюда можно получить
. Отсюда можно получить  . Так как
. Так как  , изменение внутренней энергии при таком процессе определяется выражением
, изменение внутренней энергии при таком процессе определяется выражением  .
.
Для идеального газа величина  . Следовательно
. Следовательно
 (1.6)
(1.6)
При изобарном процессе, то есть процессе, протекающем при постоянном давлении, 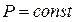 . Дифференцируя уравнение
. Дифференцируя уравнение 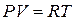 (при
(при 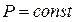 ), получаем
), получаем  . Подставив данное соотношение в (1.5) и учитывая, что
. Подставив данное соотношение в (1.5) и учитывая, что  , приходим к выражению
, приходим к выражению
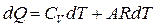
Так как рассматривается изобарный процесс, данное соотношение можно представить в виде
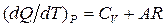
Здесь величина  – есть значение удельной теплоёмкости при постоянном давлении
– есть значение удельной теплоёмкости при постоянном давлении 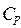 . Следовательно
. Следовательно
|
|
|
 или
или 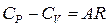 (1.7)
(1.7)
Широкое применение в термодинамике имеет функция энтропии (S), которая определяется соотношением
 (1.8)
(1.8)
Энтропия (от греческого entropia – поворот, превращение) – функция состояния термодинамической системы.
Согласно соотношению (1.8) приращение энтропии равно элементарному количеству тепла, получаемому (или отдаваемому) системой, отнесённому к температуре, при которой это тепло получается.
Из общего количества тепла можно выделить ту его часть, которая возникает в результате работы сил трения (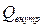 ). Очевидно, эта часть тепла всегда существенно положительна. Остальная часть тепла (
). Очевидно, эта часть тепла всегда существенно положительна. Остальная часть тепла (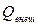 ) может быть как положительной, так и отрицательной, так как тепло к системе может подводиться либо отводиться. Следовательно
) может быть как положительной, так и отрицательной, так как тепло к системе может подводиться либо отводиться. Следовательно
 (1.9)
(1.9)
Процесс, при котором отсутствует теплообмен между веществом и внешней средой, называется адиабатическим. Из соотношения (1.9) следует, что в общем случае при адиабатическом процессе  , так как
, так как  , но
, но  . Процесс, при котором энтропия не меняется (dS = 0), возможен в невязкой среде и называется изэнтропическим (или идеальным адиабатическим процессом).
. Процесс, при котором энтропия не меняется (dS = 0), возможен в невязкой среде и называется изэнтропическим (или идеальным адиабатическим процессом).
Отдельно следует остановиться на понятиях необратимый и обратимый процессы, изолированная и неизолированная системы.
Под необратимым процессом подразумевают процесс, который самостоятельно может протекать только в одном направлении – в сторону равномерного распределения вещества, теплоты и др. Обратимый процесс возможно осуществить и в обратном направлении, последовательно повторяя все промежуточные состояния прямого процесса. Реальные природные процессы, строго говоря, являются необратимыми процессами [3].
Для изолированной системы  , но
, но  и
и 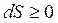 . Следовательно, энтропия изолированной системы может только возрастать, и лишь для идеальной системы она может оставаться постоянной. В этом и заключается второй закон термодинамики.
. Следовательно, энтропия изолированной системы может только возрастать, и лишь для идеальной системы она может оставаться постоянной. В этом и заключается второй закон термодинамики.
Для неизолированной системы может иметь место как 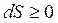 , так и
, так и  .
.
В качестве примера рассмотрим случай изолированной системы, состоящей из двух одинаковых тел, обладающих равными массами m1 = m2= m, одинаковыми значениями теплоемкостей с1 = с2 = с = 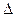 Q /
Q / 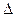 T, но различными величинами температур Т1 и Т2 (Т1 > Т2). Между телами происходит теплообмен, приводящий к выравниванию их температур. Так как m1 = m2, с1 = с2, конечная температура обоих тел определяется соотношением
T, но различными величинами температур Т1 и Т2 (Т1 > Т2). Между телами происходит теплообмен, приводящий к выравниванию их температур. Так как m1 = m2, с1 = с2, конечная температура обоих тел определяется соотношением
|
|
|
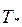 =
= 
Процесс охлаждения первого тела сопровождается изменением его энтропии


Процесс нагревания второго тела приводит к изменению его энтропии
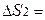
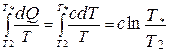
Очевидно, поскольку Т1 > Т  > Т2, то значение
> Т2, то значение  отрицательно, а
отрицательно, а  - положительно.
- положительно.
Изменение энтропии системы складывается из изменений энтропии отдельных тел
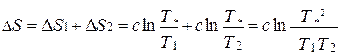
Подставив в данное выражение значение  , получаем
, получаем

Проанализируем выражение, стоящее под знаком логарифма
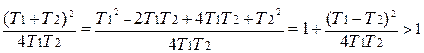
Поскольку данное выражение больше единицы, логарифм его положителен и, следовательно,  .
.
Таким образом, энтропия изолированной системы действительно может только возрастать, если в системе протекает необратимый процесс (либо оставаться постоянной, если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может.
Данное положение широко используется в науке и технике и, в первую очередь, в химии для суждения о том, можно ли осуществить нужную химическую реакцию или получить нужное вещество.
Если расчет энтропии замкнутой системы с учетом всех источников теплоты приводит к результату, при котором общая энтропия системы возрастает, то процесс необратим и может самостоятельно протекать в нужном направлении.
Если общая энтропия системы уменьшается, то процесс в заданном направлении не пойдет (или не возможен).
Соотношение  может иметь место при определенных условиях, допущениях, как, например, в упомянутом ранее случае идеального адиабатического процесса. Допущение о возможности постоянства энтропии используется при изучении отдельных физических процессов, позволяя в ряде случаев упростить решение задачи.
может иметь место при определенных условиях, допущениях, как, например, в упомянутом ранее случае идеального адиабатического процесса. Допущение о возможности постоянства энтропии используется при изучении отдельных физических процессов, позволяя в ряде случаев упростить решение задачи.
Учитывая значимость представления воздуха идеальным газом, найдём соотношение, определяющее энтропию такого газа через параметры состояния. Используя выражения (1.5), (1.6), можно записать

Так как 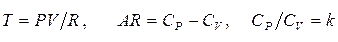 , получаем
, получаем

Интегрируя данное уравнение, находим

Отсюда следует
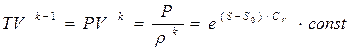 (1.10)
(1.10)
При этом изэнтропический процесс ( ) будет характеризоваться выполнением любого из следующих соотношений:
) будет характеризоваться выполнением любого из следующих соотношений:
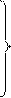
 (1.11)
(1.11)
Данные соотношения известны под названием адиабаты Пуассона, коэффициент  – показатель адиабаты.
– показатель адиабаты.
В термодинамике используется также функция состояния энтальпия  (от греческого enthalpo – нагреваю), связанная с внутренней энергией соотношением
(от греческого enthalpo – нагреваю), связанная с внутренней энергией соотношением
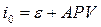 , (1.12)
, (1.12)
где V – объём системы.
В случае идеального газа
 (1.13)
(1.13)
Для идеального газа  . Дифференцируя (1.13) и сравнивая результат дифференцирования с полученным ранее соотношением
. Дифференцируя (1.13) и сравнивая результат дифференцирования с полученным ранее соотношением 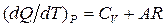 , находим
, находим

Таким образом, изменение энтальпии равно количеству тепла, подведённого к системе при постоянном давлении. Поэтому энтальпию часто называют тепловой функцией или теплосодержанием.
Законы и соотношения термодинамики играют важную роль при изучении процессов горения и взрыва. Так первое начало термодинамики (1.5) является основой при построении уравнения сохранении энергии этих процессов, второе начало (1.8) и формулы (1.6), (1.13) – при определении количественных характеристик рассматриваемых процессов и т.д.
Для полноты представления о различных тепловых процессах приведём теорему Нернста, называемую иногда третьим началом термодинамики.
Теорема гласит: при стремлении абсолютной температуры к нулю энтропия любого тела также стремится к нулю
lim S = 0 (1.14)
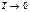
Согласно теореме энтропия любого вещества при абсолютном нуле равна нулю. При этом полностью прекращается всякий теплообмен.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 595; Нарушение авторских прав?; Мы поможем в написании вашей работы!