
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление и условие протекания самопроизвольных процессов
|
|
|
|
Термодинамические потенциалы.
1) Изобарноизотермический или энергия Гиббса (G = H – T*S)
2) Изохорноизотермический или энергия Гельмгольца (F = U – T*S)
∆G = ∆H – T*∆S ∆F = ∆U – T*∆S
dG = dH – T*dS dF = dU – T*dS
Рассмотрим закрытую систему, в которой осуществляется процесс при постоянной температуре. Согласно II закону термодинамики в такой системе разрешается протекание следующих процессов:
| обратимые | необратимые |
| T = const | |
| ∆S = Qобр / T | ∆S > Qнеобр / T |
| Qобр – T*∆S = 0 | Qнеобр – T*∆S < 0 |
| P = const | |
| Qp= ∆H; ∆H – T*∆S=∆G=0 критерий равновестного состояния системы | ∆G<0 –критерий самопроизвольности процесса (при убыли изобарноизотерм. потенциала протекание процесса в прямом направлении при заданных условиях возможно) |
∆rG° = СУММ(∆fG°*ni)(кон.) – СУММ(∆fG°*ni)(исх.) = ∆rH – T*∆rS°
В химической термодинамике большое значение имеет функция, которая называется химическим потенциалом. Хим. потенциал определяет стремление данного компонента покинуть данную фазу.
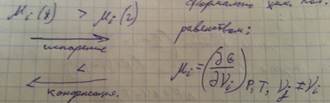
<—— Формально хим. потенциал определяется следующим образом
Хим. потенциал есть приращение изобарно изотермического потенциала данной фазы при введении дополнительного количества i-того компонента при p=const и T=const и постоянных других компонентах содержащихся в данной фазе.
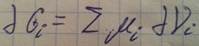
Хим. Потенциал в случае идеального газа не зависит ни от вида, ни от концентрации других компонентов и при T=const определяется следующим соотношением:
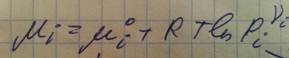
|| ||
Хим. потенциал компонента парциальное давление i-того компонента
при парциальном давлении в смеси
его равным 1.
Рассмотрим гомогенную газовую реакцию

В состоянии равновесия скорость прямой реакции = скорости обратной (Vпр. = Vобр.).


|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 495; Нарушение авторских прав?; Мы поможем в написании вашей работы!