
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Описание метода измерения и прибора
|
|
|
|
В настоящей работе для определения отношения теплоемкостей воздуха используется метод адиабатического расширения. Напомним предварительно, что адиабатическим называется процесс, протекающий при отсутствии теплообмена между системой и окружающей средой. Из первого закона термодинамики: Q = A +ΔU, где Q - количество теплоты переданное системе, ΔU - изменение внутренней энергии системы, А - работа, совершенная системой для адиабатического процесса, если Q = 0 то А = -ΔU, т.е. такой процесс, когда система совершает работу за счет уменьшения своей внутренней энергии.
Установка Клемана-Дезорма, с помощью которой осуществляется определение γ воздуха по методу адиабатического расширения изображена на риcунке 2.
Установка состоит из стеклянного сосуда 1, снабженного кранами 2 и 3, водянным манометром 4 и насосом 5. С помощью насоса при закрытом кране 2 накачиваем в сосуд воздух до тех пор, пока жидкость в левом колене манометра не достигнет некоторого значения (120-140). При сжатии воздуха его температура вначале повысится, а затем через несколько минут благодаря теплообмену с внешней средой воздух в сосуде примет комнатную температуру. В период охлаждения воздуха, созданное там давление немного снизится и потом сохраняется неизменным. Пусть при этом установившееся в сосуде избыточное давление, определяемое по разности уровней жидкости в обоих коленах манометра равно h1, а абсолютная температура окружающего воздуха в сосуде одинакова и равна Т1. Полное (абсолютное) давление в сосуде равно атмосферному давлению Po и созданному избыточному давлению h1. Р1 = Po + h1. (6)

Два параметра Р1 и Т1 характеризуют состояние воздуха в сосуде, которое называем первым состоянием.
|
|
|
Теперь откроем (на 1-2 секунды) и быстро закроем кран 2. За этот короткий промежуток времени воздух в сосуде будет расширятся практически адиабатически, пока его давление не сделается равным атмосферному, т.е. Рo. При адиабатическом расширении воздуха его температура понизится до некоторого значения Т2. Следовательно,взятое состояние воздуха будет характеризоваться параметрами Т2 и Рo(второе состояние).
 γ
γ
β
Z б)
α
а) γ β
α
X Y
Рисунок 3
Сразу после закрытия крана 2 имевшееся давление воздуха в сосуде будет повышаться,т.к. в результате теплообмена его температура будет возрастать до значения Т1, соответствующего температуре окружающего воздуха. Пусть при этом давление достигнет величины:
Р2= Рo + h2, (7)
где: h2- избыточное давление, показываемое манометром.
Таким образом третье состояние воздуха характеризуется параметрами P2, T1.Переход воздуха от 2 к 3 состоянию происходил без изменения объема. Поэтому на основании закона Гей-Люссака можем записать:
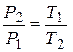 . (8)
. (8)
К процессу адиабатического расширения при переходе воздуха из состояния 1 в состояние 2 можно применять закон Пуассона, который удобно записать в следующей форме:
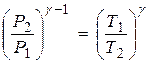 , (9)
, (9)
где: γ=ср/сv.
Из уравнения (9) непосредственно следует, что в адиабатическом процессе при повышении давления Р1(сжатие газа) его температура должна возрастать, а при понижении (расширение газа) - уменьшаться.
Уравнение Пуассона обычно представляют в виде
(P1V1)γ =(P2V2)γ (9а)
из которого легко получить равенство (9). Запишем уравнение Клапейрона-Менделеева для двух состояний:
 .
.
Возведем обе части этого равенства в степень γ и разделим почленно на уравнение (9). В результате получим уравнение (9). Заменив в равенстве (9) Р1 через его значение из уравнения (6), получим
 .
.
Представляя правую часть этого равенства в виде  для чего достаточно в числителе прибавить и отнять Т2. Теперь это равенство запишется так:
для чего достаточно в числителе прибавить и отнять Т2. Теперь это равенство запишется так:
|
|
|
 . (10)
. (10)
Прологарифмировав это выражение, будем иметь:
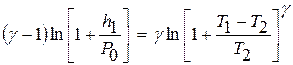 . (11)
. (11)
Величина h1/Po и Т1-Т2/Т2 много меньше 1. Поэтому руководствуясь положением, что ln(1+х) = х, если х<1, равенство (11) можно с достаточной точностью заменить на
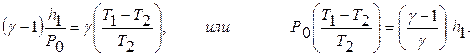
Заметим, что левая часть равенства (12) равна. Действительно, подставив в уравнение (8) значение Р2 из равенства (7), и разрешив его относительно h2, получим:
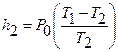 . (12)
. (12)
Теперь равенство (12) можно записать так:

Таким образом, для определения отношения теплоемкостей воздуха рассмотренным методом получили очень простое выражение. Значение находится по результатам измерений h1 и h2.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 278; Нарушение авторских прав?; Мы поможем в написании вашей работы!