
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критическая температура
|
|
|
|
Представим себе, что в цилиндре под поршнем содержится перегретый пар. Пусть температура этого пара будет 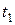 и состояние его определяется на диаграмме точкой 1 (рис. 5.5).
и состояние его определяется на диаграмме точкой 1 (рис. 5.5).
Будем сжимать этот пар, оставляя температуру его неизменной (для чего теплоту от пара нужно отводить). Такой процесс сжатия может быть графически изображен линией 1-2, которая является изотермой перегретого пара. По мере сжатия давление пара, как это видно на диаграмме, будет повышаться, а сам пар все больше приближаться к состоянию насыщения и, наконец, в точке 2 превратиться в сухой пар. При дальнейшем сжатии он перейдет в область влажного пара и будет становиться все более и более влажным (будет конденсироваться), пока не превратится весь в воду (точка 3). Так как такая конденсация происходит при постоянной температуре, то и давление пара должно также оставаться неизменным, а потому изотерма 2-3 будет являться одновременно и изобарой. Дальнейшее сжатие воды будет происходить по линии 3-4. Повторяя такой же процесс для перегретого пара, имеющего более высокую начальную температуру  и определяемого на диаграмме точкой
и определяемого на диаграмме точкой 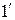 , получим изотерму
, получим изотерму 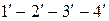 , отличающуюся от первой более коротким горизонтальным участком.
, отличающуюся от первой более коротким горизонтальным участком.

Рис. 5.5. Изображение в осях vр процессов, протекающих при
постоянных температурах
При еще более высокой начальной температуре  получим изотерму
получим изотерму  , у которой горизонтальный участок
, у которой горизонтальный участок  будет еще короче.
будет еще короче.
Наконец, если провести изотерму для пара, имеющего начальную температуру 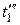 =
=  = 374 оС, то эта изотерма не пересечет кривых МК и NK, а только коснется их в критической точке К. Изотермы с температурами больше 374 оС будут проходить выше критической точки, имея над ней некоторый перегиб, который будет тем меньше, чем дальше от нее расположена изотерма и чем, следовательно выше температура перегретого пара. При очень высоких температурах этот перегиб совсем исчезнет и изотерма примет вид, свойственный изотермам газов.
= 374 оС, то эта изотерма не пересечет кривых МК и NK, а только коснется их в критической точке К. Изотермы с температурами больше 374 оС будут проходить выше критической точки, имея над ней некоторый перегиб, который будет тем меньше, чем дальше от нее расположена изотерма и чем, следовательно выше температура перегретого пара. При очень высоких температурах этот перегиб совсем исчезнет и изотерма примет вид, свойственный изотермам газов.
|
|
|
Важно отметить, что поскольку изотермы для температур выше критической не пересекают кривых МК и NK, то, следовательно, они лежат в области перегретых паров. Поэтому, если пар имеет температуру выше критической, то сколько бы его ни сжимать при постоянной температуре, он никогда не перейдет в жидкость. Это положение было впервые установлено Д.И. Менделеевым в 1861 году и может быть сформулирована следующим образом: критической температурой  называется такая температура, выше которой пар не может быть переведен при помощи изотермического сжатия в жидкость.
называется такая температура, выше которой пар не может быть переведен при помощи изотермического сжатия в жидкость.
Чем температура перегретого пара выше критической, тем он по своим свойствам больше приближается к идеальным газам. Вообще же перегретый пар можно рассматривать как несовершенный газ, т.е. не вполне подчиняющийся уравнению рv=RT.
Все реальные газы являются парами с очень низкими критическими температурами. В табл. 5.1 приведены значения критических температур и давлений для некоторых газов и водяного пара.
Таблица 5.1
Критические температуры и давления газов и водяного пара
| Название газа |  , оС , оС
|  , ата , ата
|
| Водород Н2 Азот N2 Воздух Окись углерода СО Кислород О2 Углекислота СО2 Аммиак NH3 Водяной пар Н2О | –239,71 –146,83 – 140,50 – 139,40 –118,62 + 31,10 + 130,70 + 374,15 | 12,80 33,50 38,40 35,50 50,80 75,29 114,00 225,65 |
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 656; Нарушение авторских прав?; Мы поможем в написании вашей работы!