
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поведение бинарных и многокомпонентных систем в критической области
|
|
|
|
Вы уже знаете, как изображаются составы трёхкомпонентных систем.
Состав трёхкомпонентной системы удобно изображать, пользуясь концентрационным треугольником. Вершины равностороннего треугольника отвечают содержанию в системе 100 % каждого из компонентов А, В и С. Стороны треугольника позволяют описать составы двухкомпонентных систем А+В, В+С, С+А.
Точки, лежащие внутри треугольника, описывают составы трёхкомпонентных систем.
Метод определения состава, предложенный Гиббсом, основан на том, что сумма перпендикуляров, опущенных из любой точки внутри равностороннего треугольника на каждую из сторон, равна высоте треугольника.
Фазовое поведение трёхкомпонентных углеводородных смесей в ряде случаев может быть корректно смоделировано посредством представления этих смесей как псевдобинарные.
Типовые изотермы многокомпонентных углеводородных смесей вблизи критической области показаны на рис. 5.

Рис. 5. Типовые изотермы многокомпонентных углеводородных смесей вблизи
критической области.
1 — кривая точек парообразования; 2 — кривая точек конденсации.
Как уже упоминалось, основной признак критической точки — одинаковые свойства газовой и жидкой фаз, т. е. она находится в точке соединения кривых начала конденсации и парообразования (в точке 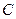 ). Из этого рисунка следует, что в критической точке давление и температура не наибольшие, при которых еще возможно одновременное существование обеих фаз. Действительно, если давление несколько меньше
). Из этого рисунка следует, что в критической точке давление и температура не наибольшие, при которых еще возможно одновременное существование обеих фаз. Действительно, если давление несколько меньше 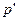 , но больше, чем критическое
, но больше, чем критическое 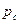 , в системе появляется газовая фаза, находящаяся в равновесии с жидкой. Это относится ко всей области
, в системе появляется газовая фаза, находящаяся в равновесии с жидкой. Это относится ко всей области 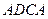 . Точно также в области
. Точно также в области  существуют одновременно две фазы несмотря на то, что при этом температура в системе выше критической
существуют одновременно две фазы несмотря на то, что при этом температура в системе выше критической 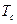 . Наибольшее давление (
. Наибольшее давление ( 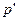 на рис. 5), при котором жидкость и пар могут существовать в равновесии, принято называть криконденбар. Наивысшая температура (
на рис. 5), при котором жидкость и пар могут существовать в равновесии, принято называть криконденбар. Наивысшая температура ( на рис. 5), при которой жидкость и пар существуют в равновесии, называется крикондентерм.
на рис. 5), при которой жидкость и пар существуют в равновесии, называется крикондентерм.
|
|
|
В области выше критической с изменением температуры и давления в многокомпонентной системе происходят необычные фазовые превращения. Чтобы убедиться в этом, рассмотрим изобарическое расширение насыщенной газом жидкости по линии 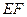 (рис. 5) вследствие повышения температуры от
(рис. 5) вследствие повышения температуры от 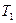 до
до  . В точке
. В точке  с увеличением температуры жидкость закипает. По мере увеличения температуры вначале объем газовой фазы увеличивается. Однако с дальнейшим повышением температуры объем газовой фазы, достигнув максимума, очевидно, вновь начинает уменьшаться, так как в точке
с увеличением температуры жидкость закипает. По мере увеличения температуры вначале объем газовой фазы увеличивается. Однако с дальнейшим повышением температуры объем газовой фазы, достигнув максимума, очевидно, вновь начинает уменьшаться, так как в точке 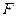 , так же как и в точке
, так же как и в точке  , лежащей на кривой начала парообразования, содержание паровой фазы в системе равно нулю.
, лежащей на кривой начала парообразования, содержание паровой фазы в системе равно нулю.
Необычные процессы испарения и конденсации возможны также и при температурах выше критических - в области  . Например, при изотермическом расширении от точки
. Например, при изотермическом расширении от точки  до
до  , расположенных на линии точек начала конденсации, система проходит двухфазную область. Причем количество конденсата в ней вначале увеличивается. После достижения максимума жидкая фаза далее в точке М исчезает. Аналогичные явления в области выше критических
, расположенных на линии точек начала конденсации, система проходит двухфазную область. Причем количество конденсата в ней вначале увеличивается. После достижения максимума жидкая фаза далее в точке М исчезает. Аналогичные явления в области выше критических 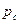 и
и 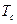 наблюдаются не только при изотермическом или изобарическом расширении и сжатии смеси, но также и при осуществлении процесса по любой другой кривой.
наблюдаются не только при изотермическом или изобарическом расширении и сжатии смеси, но также и при осуществлении процесса по любой другой кривой.
Рассмотренные необычные процессы фазовых превращений двух и многокомпонентных систем в области выше критической называются процессами обратного или ретроградного испарения и конденсации.
Фазовая диаграмма, приведенная на рис. 5, типична для многих систем. Однако условия возникновения ретроградных явлений и вид  – диаграммы (
– диаграммы ( - удельный объем,
- удельный объем, 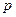 - давление и
- давление и  - абсолютная температура) в области критических точек могут быть в зависимости от состава углеводородных смесей другими. Так, например, на рис. 6 показаны фазовые диаграммы в координатах
- абсолютная температура) в области критических точек могут быть в зависимости от состава углеводородных смесей другими. Так, например, на рис. 6 показаны фазовые диаграммы в координатах 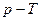 (давление - температура), построенные для других условий возникновения ретроградных явлений. Диаграмма (рис. 6, а) аналогична зависимости
(давление - температура), построенные для других условий возникновения ретроградных явлений. Диаграмма (рис. 6, а) аналогична зависимости 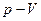 , приведенной на рис. 5. Здесь в области
, приведенной на рис. 5. Здесь в области 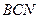 возникают процессы обратной изотермической конденсации, а в области
возникают процессы обратной изотермической конденсации, а в области  - процессы обратного изобарического испарения.
- процессы обратного изобарического испарения.
|
|
|
Если критическая область характеризуется диаграммой (рис. 6, б), где критическая точка 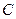 существует при давлении и температуре ниже максимальных
существует при давлении и температуре ниже максимальных 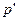 и
и  , лежащих на кривой парообразования, то изотермическое обратное испарение происходит в области
, лежащих на кривой парообразования, то изотермическое обратное испарение происходит в области  , а изобарическое ретроградное испарение - в области
, а изобарическое ретроградное испарение - в области  .
.
Обычно критическая точка находится справа от максимального давления, при котором могут одновременно сосуществовать жидкая и газовая фазы, когда в углеводородной смеси массовая концентрация гептана и более тяжелых фракций высокая, а метана низкая (см. рис. 4, б).
Ретроградные явления характеризуются диаграммой вида (рис. 6, в), когда максимальное давление 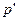 находится на кривой точек конденсации, а критическое давление — между
находится на кривой точек конденсации, а критическое давление — между 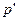 и давлением, соответствующим крикондентерме
и давлением, соответствующим крикондентерме  . Изотермическая ретроградная конденсация возникает тогда по любой вертикальной линии в области
. Изотермическая ретроградная конденсация возникает тогда по любой вертикальной линии в области  . В области
. В области  могут происходить явления обратной изобарической конденсации. Такие диаграммы характерны для жирных и конденсатных газов.
могут происходить явления обратной изобарической конденсации. Такие диаграммы характерны для жирных и конденсатных газов.

Рис. 6. Различные виды фазовых диаграмм.
1 — кривая точек парообразования; 2 — кривая точек конденсации.
Из рис. 5 и 6 следует, что изотермические ретроградные явления происходят только при температурах выше критической и ниже максимальной двухфазной температуры (крикондентермы). Изобарические процессы испарения и конденсации наблюдаются между критическим и максимальным двухфазным давлением (криконденбарой).
Ретроградные процессы испарения и конденсации сопровождаются непрерывным изменением состава и объемного соотношения жидкой и паровой фаз. Например, по диаграмме (рис. 7), соответствующей фазовой диаграмме, приведенной на рис. 6, в, можно проследить за течением процессов обратного испарения и конденсации.
|
|
|
На рис. 7 нанесены дополнительные кривые, характеризующие количество (в процентах) углеводородов в системе, находящихся в жидком состоянии при различных давлениях и температурах. По изотерме (допустим, 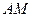 ) от давления начала конденсации до области более высоких давлений можно проследить за характером ретроградного процесса. При давлении, соответствующем точке
) от давления начала конденсации до области более высоких давлений можно проследить за характером ретроградного процесса. При давлении, соответствующем точке 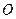 , молекулы приблизятся друг к другу достаточно, чтобы силы притяжения начали действовать между тяжелыми молекулами; образуется жидкая фаза, состоящая в основном из тяжелых углеводородов. Этот процесс будет происходить до давления
, молекулы приблизятся друг к другу достаточно, чтобы силы притяжения начали действовать между тяжелыми молекулами; образуется жидкая фаза, состоящая в основном из тяжелых углеводородов. Этот процесс будет происходить до давления 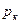 . При этом давлении выделяется максимальное количество жидкой фазы и называется оно давлением максимальной конденсации. С дальнейшим повышением давления притяжение между легкими молекулами, оставшимися в газе, до этого слабое станет более эффективным из-за большей близости молекул. С этого момента молекулы сконденсировавшихся углеводородов начинают вновь втягиваться в паровую фазу. С увеличением давления выше
. При этом давлении выделяется максимальное количество жидкой фазы и называется оно давлением максимальной конденсации. С дальнейшим повышением давления притяжение между легкими молекулами, оставшимися в газе, до этого слабое станет более эффективным из-за большей близости молекул. С этого момента молекулы сконденсировавшихся углеводородов начинают вновь втягиваться в паровую фазу. С увеличением давления выше 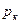 взаимодействие молекул в жидкости также несколько уменьшается вследствие растворения в ней легких углеводородов. Относительная плотность газовой фазы увеличивается, и компоненты жидкой фазы начинают все более и более растворяться в плотной газовой фазе до тех пор, пока не закончится процесс ретроградного испарения. Из сказанного следует, что процесс ретроградного испарения можно упрощенно рассматривать как процесс растворения тяжелых компонентов в плотной паровой фазе подобно тому, как тяжелые фракции нефти растворяются в легком бензине.
взаимодействие молекул в жидкости также несколько уменьшается вследствие растворения в ней легких углеводородов. Относительная плотность газовой фазы увеличивается, и компоненты жидкой фазы начинают все более и более растворяться в плотной газовой фазе до тех пор, пока не закончится процесс ретроградного испарения. Из сказанного следует, что процесс ретроградного испарения можно упрощенно рассматривать как процесс растворения тяжелых компонентов в плотной паровой фазе подобно тому, как тяжелые фракции нефти растворяются в легком бензине.
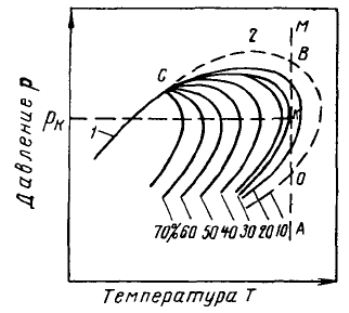
Рис. 7. Фазовая диаграмма вблизи критической точки.
1 - кривая точек парообразования; 2 - кривая точек конденсации.
Описанные явления обратной конденсации часто встречаются в природных условиях. Залежи, которым свойственны ретроградные явления, называются газоконденсатными.
|
|
|
|
|
Дата добавления: 2014-12-23; Просмотров: 323; Нарушение авторских прав?; Мы поможем в написании вашей работы!