
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общий случай 2 страница
|
|
|
|
Молекулярно кинетическая теория идеальных газов. Статистический и термодинамический методы. Идеальный газ. Законы идеального газа. Термодинамические параметры. Основное уравнение молекулярно — кинетической теории идеальных газов. Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям. Барометрическая формула. Распределение Больцмана. Среднее число столкновении и средняя длина свободного пробега молекул. Явления переноса (теплопроводность, диффузия, внутреннее трение)
Молекулярно кинетическая теория – раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество.
Статистический и термодинамический методы исследования.
Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетнческнй) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода. Этот метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т. д.). Нельзя говорить о температуре одной молекулы. Таким образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул.
|
|
|
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического. Термодинамика базируется на двух началах — фундаментальных законах, установленных в результате обобщения опытных данных.
Область применения термодинамики значительно шире, чем молекулярно-кинетической теории, ибо нет таких областей физики и химии, в которых нельзя было бы пользоваться термодинамическим методом. Однако, с другой стороны, термодинамический метод несколько ограничен: термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования.
Термодинамика имеет дело с термодинамической системой — совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Основа термодинамического метода — определение состояния термодинамической системы. Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и удельный объем.
|
|
|
Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Две температурные шкалы — термодинамическую и Международную практическую.
Удельный объем v — это объем единицы массы. Когда тело однородно, т. с. его плотность р = const, то v = V/m = l/ 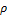 . Так как при постоянной массе удельный объем пропорционален общему объему, то макроскопические свойства однородного тела можно характеризовать объемом тела.
. Так как при постоянной массе удельный объем пропорционален общему объему, то макроскопические свойства однородного тела можно характеризовать объемом тела.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1)  собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Закон Бойля — Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV = const при Т = const.
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой.
Законы Гей-Люссака: 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
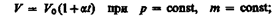
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:

В этих уравнениях t — температура по шкале Цельсия, р0 иV0 — давление и объем при 0°С,коэффициент a = 1/273,15 К-1.
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t этот процесс изображается прямой, называемой изобарой.

Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах р, t он изображается прямой, называемой изохорой.
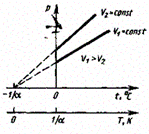
Вводя в формулы термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
|
|
|

Важной задачей МКТ является установление связи между микроскопическими параметрами газа (массой, скоростью, импульсом, кинетической энергией молекул) и его макроскопическими параметрами (температурой, давлением и объемом). Эту взаимосвязь устанавливает основное уравнение МКТ.
Идеальный газ, который в объеме V содержит N молекул, движущихся со скоростями v1, v2,..., vn. Введем среднюю квадратичную скорость,  которая характеризует всю совокупность молекул газа.
которая характеризует всю совокупность молекул газа.
Основное уравнение молекулярно-кинетической теории идеальных газов имеет вид: P=(1/3)nm0<vкв>2. Тепловое движение молекул характеризуется средней кинетической энергией молекулы: <ε>=m0<vкв>2/2. Тогда уравнение МКТ: P=(2/3)n<ε>. Если вместо концентрации молекул n использовать выражение n=ρ/m0, где ρ - плотность газа, то уравнение МКТ примет вид: P=(1/3)ρ<vкв>2. Если вместо концентрации молекул n использовать выражение n=N/V, то уравнение примет вид: P=(2/3)n<ε>=(2N/3V)<ε> → PV=(2/3)N<ε>. Далее, произведение N<ε> можно представить в виде: 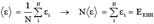 , где Eкин - кинетическая энергия всех молекул газа. В этом случае уравнение перепишем как: PV=(2/3)Eкин. Сравнив это уравнение с уравнением Менделеева-Клапейрона, можно записать:(2/3)Eкин=(m/M)RT → Eкин=(3m/2M)RT. То есть общая кинетическая энергия всех молекул прямо пропорциональна температуре. Преобразуем выражение для средней энергии одной молекулы следующим образом:
, где Eкин - кинетическая энергия всех молекул газа. В этом случае уравнение перепишем как: PV=(2/3)Eкин. Сравнив это уравнение с уравнением Менделеева-Клапейрона, можно записать:(2/3)Eкин=(m/M)RT → Eкин=(3m/2M)RT. То есть общая кинетическая энергия всех молекул прямо пропорциональна температуре. Преобразуем выражение для средней энергии одной молекулы следующим образом:  или
или
<ε>=m0<v2>/2=3kT/2. Исходя из этого выражения, можно найти среднюю квадратичную скорость молекул: <vкв>=√<v2>=√(3kT/m0)=√(3RT/M)
В газе, находящемся в состоянии равновесия, устанавливается стационарное распределение молекул по скоростям, подчиняющееся определенному статистическому закону. Этот закон был выведен теоретически Дж. Максвеллом. Максвелл предполагал, что вещество состоит из очень большого числа тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Также предполагалось, что силовые поля на газ не действуют.
|
|
|
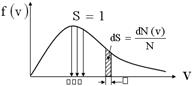
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по модулям скоростей. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), скорости которых заключены в этом интервале.
Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, то есть: dN(v)/N=f(v)dv, откуда f(v)=dN(v)/Ndv.
Применяя методы теории вероятностей, Дж. Максвелл нашел вид функции распределения молекул идеального газа по модулям скоростей хаотического движения: 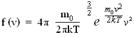 . Из этого следует, что конкретное распределение зависит от рода газа (от массы молекулы) и от его термодинамической температуры. Очевидно, что функция распределения не зависит ни от давления, ни от объема газа. График функции распределения имеет вид:
. Из этого следует, что конкретное распределение зависит от рода газа (от массы молекулы) и от его термодинамической температуры. Очевидно, что функция распределения не зависит ни от давления, ни от объема газа. График функции распределения имеет вид:
Атмосферное давление на какой-либо высоте h обусловлено весом слоёв газа, лежащих выше. Пусть P – давление на высоте h, а P+dP – на высоте h+dh
Причём, d h >0, а d Р < 0, так как на большей высоте давление меньше. Разность давления  равна весу газа, заключённого в объёме цилиндра с площадью основания равного единице и высотой d h.
равна весу газа, заключённого в объёме цилиндра с площадью основания равного единице и высотой d h. 
Т.к.  где
где 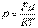 - плотность газа на высоте h, медленно убывающая с высотой, то можно записать:
- плотность газа на высоте h, медленно убывающая с высотой, то можно записать: 
Отсюда можно получить барометрическую формулу:  где P0 – давление на высоте h = 0.
где P0 – давление на высоте h = 0.
Из формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура (например, на больших высотах концентрация легких газов Не и Н2 гораздо больше, чем у поверхности Земли).
На рисунке изображены две кривые, которые можно трактовать, либо как соответствующие разным μ (при одинаковой Т), либо как отвечающие разным Т, при одинаковых μ. Таким образом, чем тяжелее газ (больше μ) и чем ниже температура, тем быстрее убывает давление.

Исходя из основного уравнения молекулярно-кинетической теории: P = nkT, заменим P и P0 в барометрической формуле на n и n0 и получим распределение Больцмана для молярной массы газа:  где n0 и n - число молекул в единичном объёме на высоте h = 0 и h.
где n0 и n - число молекул в единичном объёме на высоте h = 0 и h.
Так как  а
а 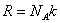 , то уравнение можно представить в виде
, то уравнение можно представить в виде  (*)
(*)
С уменьшением температуры число молекул на высотах, отличных от нуля, убывает. При T = 0 тепловое движение прекращается, все молекулы расположились бы на земной поверхности. При высоких температурах, наоборот, молекулы оказываются распределёнными по высоте почти равномерно, а плотность молекул медленно убывает с высотой. Так как mgh – это потенциальная энергия U, то на разных высотах U = mgh – различна. Следовательно, (*) характеризует распределение частиц по значениям потенциальной энергии:  – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0. Больцман доказал, что этог соотношение справедливо не только в потенциальном поле сил гравитации, но и в любом потенциальном поле, для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
– это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0. Больцман доказал, что этог соотношение справедливо не только в потенциальном поле сил гравитации, но и в любом потенциальном поле, для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
На рисунке показана зависимость концентрации различных газов от высоты. Видно, что число более тяжелых молекул с высотой убывает быстрее, чем легких.

Отношение концентраций молекул в точках с U1 и i>U2 равно: 
| . |
Молекулы газа, находясь в хаотическом движения, непрерывно сталкиваются друг с друго м. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, называемым длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с очень большим числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул <l>. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
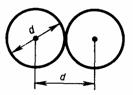
Так как за 1 с молекула в среднем проходит путь, который равен средней арифметической скорости <v>, и если < z > — среднее число столкновений, которые одна молекула газа делает за 1 с, то средняя длина свободного пробега будет: 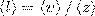 . Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других как бы застывших молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри так называемого ломаного цилиндра радиусом d. Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра:
. Для определения < z > представим себе молекулу в виде шарика диаметром d, которая движется среди других как бы застывших молекул. Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри так называемого ломаного цилиндра радиусом d. Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра: 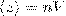 , где n — концентрация молекул, V = πd2<v>,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом, среднее число столкновений:
, где n — концентрация молекул, V = πd2<v>,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом, среднее число столкновений: 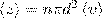 . При учете движения других молекул:
. При учете движения других молекул: 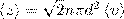 . Тогда средняя длина свободного пробега:
. Тогда средняя длина свободного пробега:  , т. е. <l> обратно пропорциональна концентрации n молекул. С другой стороны, p=nkt. Значит,
, т. е. <l> обратно пропорциональна концентрации n молекул. С другой стороны, p=nkt. Значит, 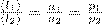 .
.

В термодинамически неравновесных системах происходят особые необратимые процессы, называемые явлениями переноса, в результате которых осуществляется пространственный перенос массы, импульса, энергии. К явлениям переноса относятся теплопроводность (перенос энергии), диффузия (перенос массы) и внутреннее трение (перенос импульса).
1) Теплопроводность. Если в первой области газа средняя кинетическая энергия молекул больше, чем во второй, то вследствие постоянных столкновений молекул с течением времени происходит процесс выравнивания средних кинетических энергий молекул, т. е., выравнивание температур. Перенос энергии в форме теплоты подчиняется закону Фурье: 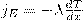 , где jE — плотность теплового потока — величина, которая определяется энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х, λ — теплопроводность, — градиент температуры, равный скорости изменения температуры на единицу длины х в направлении нормали к этой площадке. Знак минус говорит о том, что во время теплопроводности энергия перемещается в направлении убывания температуры (поэтому знаки jE и – противоположны). Теплопроводность λ равна плотности теплового потока при градиенте температуры, равном единице.
, где jE — плотность теплового потока — величина, которая определяется энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х, λ — теплопроводность, — градиент температуры, равный скорости изменения температуры на единицу длины х в направлении нормали к этой площадке. Знак минус говорит о том, что во время теплопроводности энергия перемещается в направлении убывания температуры (поэтому знаки jE и – противоположны). Теплопроводность λ равна плотности теплового потока при градиенте температуры, равном единице. 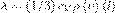 , где сV — удельная теплоемкость газа при постоянном объеме (количество теплоты, которое необходимо для нагревания 1 кг газа на 1 К при постоянном объеме), ρ — плотность газа, <ν> — средняя скорость теплового движения молекул, <l> — средняя длина свободного пробега.
, где сV — удельная теплоемкость газа при постоянном объеме (количество теплоты, которое необходимо для нагревания 1 кг газа на 1 К при постоянном объеме), ρ — плотность газа, <ν> — средняя скорость теплового движения молекул, <l> — средняя длина свободного пробега.
2) Диффузия. Происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия есть обмен масс частиц этих тел, при этом явление возникает и продолжается, пока существует градиент плотности. Явление диффузии для химически однородного газа подчиняется закону Фика:  , где jm — плотность потока массы — величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку, перпендикулярную оси х, D — диффузия (коэффициент диффузии), dρ/dx — градиент плотности, который равен скорости изменения плотности на единицу длины х в направлении нормали к этой площадке. Знак минус говорит о том, что перенос массы происходит в направлении убывания плотности (поэтому знаки jm и dρ/dx противоположны). Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице. Согласно кинетической теории газов,
, где jm — плотность потока массы — величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку, перпендикулярную оси х, D — диффузия (коэффициент диффузии), dρ/dx — градиент плотности, который равен скорости изменения плотности на единицу длины х в направлении нормали к этой площадке. Знак минус говорит о том, что перенос массы происходит в направлении убывания плотности (поэтому знаки jm и dρ/dx противоположны). Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице. Согласно кинетической теории газов, 
3) Внутреннее трение (вязкость). Суть механизма возникновения внутреннего трения между параллельными слоями газа (жидкости), которые движутся с различными скоростями, есть в том, что из-за хаотического теплового движения осуществляется обмен молекулами между слоями, в результате чего импульс слоя, который движется быстрее, уменьшается, который движется медленнее — увеличивается, что приводит к торможению слоя, который движется быстрее, и ускорению слоя, который движется медленнее. Как известно, сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона:  , где η — динамическая вязкость (вязкость), dν/dx — градиент скорости, который показывает быстроту изменения скорости в направлении х, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила F. Согласно второму закону Ньютона взаимодействие двух слоев можно рассматривать как процесс, при котором в единицу времени от одного слоя к другому передается импульс, который по модулю равен действующей силе. Тогда выражение можно записать в виде:
, где η — динамическая вязкость (вязкость), dν/dx — градиент скорости, который показывает быстроту изменения скорости в направлении х, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила F. Согласно второму закону Ньютона взаимодействие двух слоев можно рассматривать как процесс, при котором в единицу времени от одного слоя к другому передается импульс, который по модулю равен действующей силе. Тогда выражение можно записать в виде:  , где jp — плотность потока импульса — величина, которая определяется определяемая полным импульсом, переносимым в единицу времени в положительном направлении оси х через единичную площадку, перпендикулярную оси х, dν/dx — градиент скорости. Знак минус говорит о том, что импульс переносится в направлении убывания скорости (поэтому знаки jp и dν/dx противоположны). Динамическая вязкость η численно равна плотности потока импульса при градиенте скорости, равном единице; она вычисляется по формуле:
, где jp — плотность потока импульса — величина, которая определяется определяемая полным импульсом, переносимым в единицу времени в положительном направлении оси х через единичную площадку, перпендикулярную оси х, dν/dx — градиент скорости. Знак минус говорит о том, что импульс переносится в направлении убывания скорости (поэтому знаки jp и dν/dx противоположны). Динамическая вязкость η численно равна плотности потока импульса при градиенте скорости, равном единице; она вычисляется по формуле: 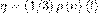 .
.
Динамика поступательного движения. Три закона Ньютона. Масса. Сила (трения, гравитации, сила тяжести, вес тела, сила упругости). Невесомость. Закон сохранения импульса. Энергия, работа, мощность. Кинетическая и потенциальная энергия. Закон сохранения энергии. Удар абсолютно упругих и неупругих тел.
В динамике изучают законы движения тел с учетом причин, обуславливающих характер данного движения.
Меру взаимодействия тел, в результате которого тела деформируются или приобретают ускорения, называют силой. Сила - величена векторная; она характеризуется числовым значением, направлением действия и точкой приложения к телу.
Всякое тело находится в состоянии покоя или равномерного прямолинейного движения, пока приложенные к телу силы не вызовут изменения этого состояния. Это свойство, присущее всем телам, называют инерцией, а тела, им обладающие,- инертными.
Меру инертности тел при поступательном движении называют массой тел.
I закон Ньютона. Если равнодействующая всех сил, приложенных к телу, равна нулю, то точка находится в состоянии покоя или равномерного прямолинейного движения.
 ;
; 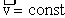 .
.
II закон Ньютона. Второй закон Ньютона устанавливает соотношения между силой, массой и ускорением.
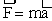 .
.
Если учесть; что  , то получим второй закон в другом виде:
, то получим второй закон в другом виде: 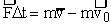 .
.
Импульс силы, действующей на тело равен изменению ипульса тела.
III закон Ньютона. Силы, с которыми два тела действуют друг на друга, направлены по одной прямой, равны по модулю, но противоположны по направлению.
 или
или  .
.
Масса тела. Свойство тела, от которого зависит его ускорение при взаимодействии с другими телами, называетсяинертностью.
Количественной мерой инертности тела является масса тела. Чем большей массой обладает тело, тем меньшее ускорение оно получает при взаимодействии.
Поэтому в физике принято, что отношение масс взаимодействующих тел равно обратному отношению модулей ускорений:
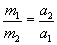 . (5.2)
. (5.2)
За единицу массы в Международной системе принята масса специального эталона, изготовленного из сплава платины и иридия. Масса этого эталона называется килограммом (кг).
Масса тела может быть выражена через массу эталона:
 . (5.4)
. (5.4)
Масса тела — это физическая величина, характеризующая его инертность.
Силы трения покоя. Сила трения покоя 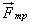 равна по модулю внешней силе
равна по модулю внешней силе  , направленной по касательной к поверхности соприкосновения тел, и противоположна ей по направлению (рис. 36):
, направленной по касательной к поверхности соприкосновения тел, и противоположна ей по направлению (рис. 36): 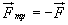 .
.

Сила трения скольжения. Вектор силы трения скольжения 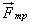 всегда направлен противоположно вектору скорости
всегда направлен противоположно вектору скорости 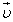 движения тела относительно соприкасающегося с ним тела. Поэтому действие силы трения скольжения всегда приводит к уменьшению модуля относительной скорости тел.
движения тела относительно соприкасающегося с ним тела. Поэтому действие силы трения скольжения всегда приводит к уменьшению модуля относительной скорости тел.
Природа силы трения. Силы трения возникают благодаря существованию сил взаимодействия между молекулами и атомами соприкасающихся тел. Последние обусловлены взаимодействием электрических зарядов, которыми обладают частицы, входящие в состав атомов.
В рамках классической механики гравитационное взаимодействие описывается законом всемирного тяготения Ньютона, который гласит, что сила гравитационного притяжения между двумя материальными точками массы  и
и  , разделёнными расстоянием
, разделёнными расстоянием  , пропорциональна обеим массам и обратно пропорциональна квадрату расстояния — то есть:
, пропорциональна обеим массам и обратно пропорциональна квадрату расстояния — то есть:

Здесь 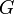 — гравитационная постоянная, равная примерно 6,6725×10-11 м³/(кг·с²).
— гравитационная постоянная, равная примерно 6,6725×10-11 м³/(кг·с²).
Силу, с которой тело притягивается к Земле под действием поля тяготения Земли, называют силой тяжести. По закону всемирного тяготения на поверхности Земли (или вблизи этой поверхности) на тело массой m действует сила тяжести
Fт=GMm/R2 (2.28)
где М - масса Земли; R - радиус Земли.
Если на тело действует только сила тяжести, а все другие силы взаимно уравновешены, тело совершает свободное падение. Согласно второму закону Ньютона и формуле (2,28) модуль ускорения свободного падения g находят по формуле
g=Fт/m=GM/R2. (2.29)
Из формулы (2.29) следует, что ускорение свободного падения не зависит от массы m падающего тела, т.е. для всех тел в данном месте Земли оно одинаково. Из формулы (2.29) следует, что Fт = mg
Силу, в которой вследствие притяжения к Земле тело действует на свою опору или подвес, называютвесом тела. Р=Fт=mg.
Силы Fт и Fуп направлены по одной вертикальной прямой. Поэтому если ускорение тела а направлено вниз (т.е. совпадает по направлению с ускорением свободного падения g), то по модулю
P=m(g-a) (2.33)
Если же ускорение тела направлено вверх (т. е. противоположно направлению ускорения свободного падения), то Р = m[g - (- а)] = m(g+а).
При свободном падении a=g. Из (2.33) следует, что в таком случае Р=0, т. е. вес отсутствует. Следовательно, если тела движутся только под действием силы тяжести (т. е. свободно падают), они находятся в состоянии невесомости. Характерным признаком этого состояния является отсутствие у свободно падающих тел деформаций и внутренних напряжений, которые вызываются у покоящихся тел силой тяжести. Причина невесомости тел заключается в том, что сила тяжести сообщает свободно падающему телу и его опоре (или подвесу) одинаковые ускорения.
Си́ла упру́гости — сила, возникающая при деформации тела и противодействующая этой деформации.
В случае упругих деформаций является потенциальной. Сила упругости имеет электромагнитную природу, являясь макроскопическим проявлением межмолекулярного взаимодействия. В простейшем случае растяжения/сжатия тела сила упругости направлена противоположно смещению частиц тела, перпендикулярно поверхности.
В словесной форме закон звучит следующим образом:
Сила упругости, возникающая в теле при его деформации, прямо пропорциональна величине этой деформации
Для тонкого растяжимого стержня закон Гука имеет вид:

Здесь 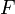 — сила натяжения стержня,
— сила натяжения стержня,  — абсолютное удлинение (сжатие) стержня, а
— абсолютное удлинение (сжатие) стержня, а 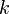 называется коэффициентом упругости (или жёсткости).
называется коэффициентом упругости (или жёсткости).
Коэффициент упругости зависит как от свойств материала, так и от размеров стержня. Можно выделить зависимость от размеров стержня (площади поперечного сечения  и длины
и длины  ) явно, записав коэффициент упругости как
) явно, записав коэффициент упругости как
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 497; Нарушение авторских прав?; Мы поможем в написании вашей работы!