
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроды третьего рода
|
|
|
|
Электроды второго рода
Электроды второго рода – системы, у которых значение электродных потенциалов не зависит от активности окисленной и восстановленной формы металла, а определяется активностью анионов, не принимающих участие в окислительно-восстановительных превращениях. Представляет собой металл, покрытый труднорастворимым соединением данного металла и погруженный в раствор, содержащий общий анион с труднорастворимым соединением.
Среди электродов второго рода наиболее распространенными являются хлорсеребряный и каломельный электроды, которые применяют в качестве электродов сравнения.
Хлорсеребряный (описание – методичка – стр. 47!!!!!!!!!!!)

Каломельный электрод (описание – методичка – стр. 48!!!!!!!!!!!)
½ Hg2Cl2 + e− = Hg + Cl− Cl−|Hg2Cl2|Hg|Pt
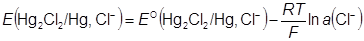

¨ Электроды третьего рода – системы, у которых значение электродного потенциала не зависит от активности окисленной и восстановленной формы, а определяется активностью катиона в растворе
AgCl + e− + ½ Pb2+ = Ag + ½ PbCl2
Pb2+|PbCl2|AgCl|Ag
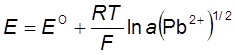
Окислительно-восстановительные электроды (описание – методичка – стр. 49!!!!!!!!!!!)
¨ Окислительно-восстановительные электроды – системы, электродный потенциал которых зависит от активности окисленной и восстановленной форм ионов в растворе
Fe3+ + e− = Fe2+ Fe3+,Fe2+|Pt

ГАЗОВЫЕ ЭЛЕКТРОДЫ.
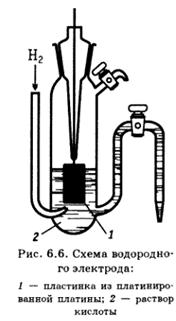 Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина).
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина).
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода: H+ êH2 êPt
|
|
|
Электродная реакция: 2Н+ + 2 е = Н2
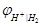 =
= 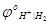 + 2,303
+ 2,303 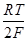 lg
lg  = 2,303
= 2,303  lg
lg 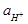 - 2,303
- 2,303 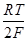 lg
lg 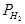
Потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода
КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода: ОН- êО2 êPt
Электродная реакция: О2 + 2Н2О + 4 е = 4ОН-
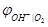 =
= 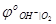 + 2,303
+ 2,303 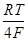 lg
lg 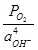 =
= 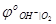 + 2,303
+ 2,303 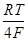 lg
lg 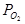 - 2,303
- 2,303  lg
lg 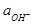
Однако реализовать кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, часть кислорода восстанавливается на электроде не до воды, а до ионов перекиси водорода.
8) Мембранные электроды, Потенциал Доннана, потенциал асимметрии, стеклянный электрод, ионселективные электроды.




 Стеклянный электрод
Стеклянный электрод
•  Для измерения pH растворов можно использовать газовый водородный электрод, но на практике для этого обычно используют стеклянный электрод
Для измерения pH растворов можно использовать газовый водородный электрод, но на практике для этого обычно используют стеклянный электрод
• Как правило, используют цепь
Ag|AgCl|KCl(нас.)||H+|стекло|KCl|AgCl|Ag
• Для стеклянного электрода

где E ºэл – стандартный потенциал электрода; β – эмпирический параметр
• E ºэл и β определяют калибровкой
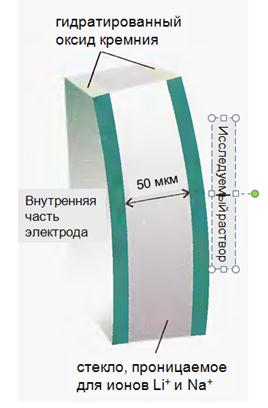
¨ Механизм действия
¨ Мембрана проницаема для Li+ и Na+, но не H3O+
¨ Ионы H3O+ модифицируют поверхностный слой на внутренней и внешней поверхности электродов
¨ Степень модификации зависит от активности ионов водорода в растворе
¨ Изменение заряда внешнего слоя передается на внутренний слой с помощью ионов Na+ и Li+, находящихся в стекле



9) Классификация Электрохимических Цепей
¨ По источнику электрической энергии
¤ Физические
¤ Концентрационные
¤ Химические
¨ По наличию или отсутствию в цепи границы между двумя растворами
¤ Цепи с переносом (без границы)
¤ Цепи без переноса
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 4174; Нарушение авторских прав?; Мы поможем в написании вашей работы!