
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовое перенапряжение. Катодное выделение водорода и металлов
|
|
|
|
Три основных уравнения диффузионной кинетики.
1-е:
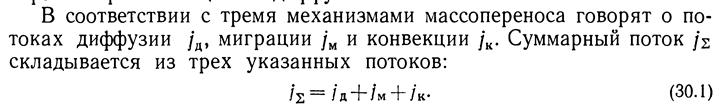


2-е


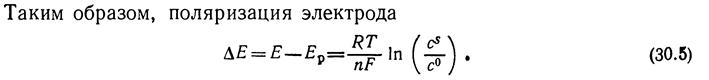
Или:

3-е
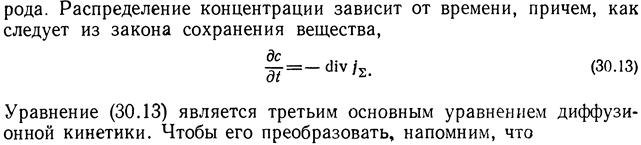
После преобразования

4.6) поляризационные кривые:
Графическую зависимость потенциала от плотности тока называют поляризационной кривой. Пусть отсутствует миграция и конвекция. Тогда
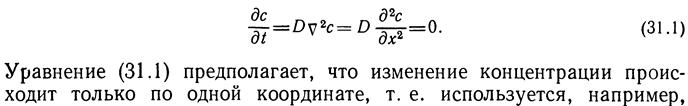

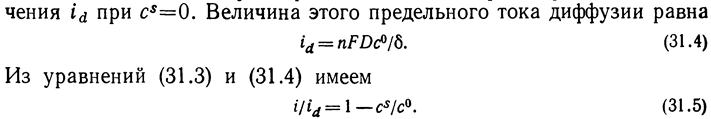



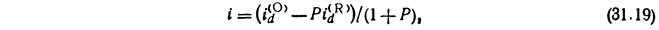 ,
,
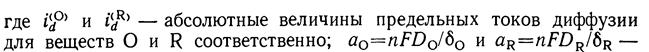
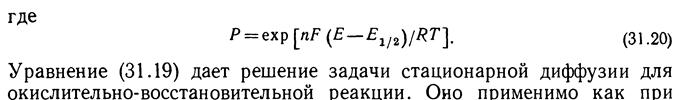 , где
, где 
Поляризационные кривые



Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения.
Электролиз может начаться после того, как приложенная извне разность потенциалов достигает величины, равной (вернее, очень незначительно превышающей) разности обратимых потенциалов электродов электрохимической ячейки (потенциалы разряда ионов). Однако во многих случаях для того, чтобы электролиз начался, необходимо приложить к электролитической ванне разность потенциалов, на конечную величину большую, чем разность равновесных потенциалов электродов, образующихся при электролизе. Эта минимальная величина приложенной извне разности потенциалов называется напряжением разложения. То избыточное напряжение, которое необходимо приложить к ванне сверх ее равновесной ЭДС, чтобы начался электролиз, включает в себя, во-первых, перенапряжение на электродах (на катоде и на аноде), а во-вторых, омическое падение напряжения в растворе, соответствующее электросопротивлению этого раствора.
Величина перенапряжения на электроде зависит от природы электрода, плотности тока, состава раствора и др. факторов. Величина перенапряжения различна для разных электрохимических процессов.
В связи с большим практическим значением реакции выделения водорода для ряда технических процессов (электролиз воды, хлорный электролиз, эксплуатация аккумуляторов и гальванических элементов, коррозия) эта электрохимическая реакция изучена наиболее детально.
|
|
|
ТЕОРИИ ВОДОРОДНОГО ПЕРЕНАПРЯЖЕНИЯ.
Электрохимические реакции являются сложными процессами с последовательными стадиями, и малая скорость любой из них приводит к нарушению равновесия и появлению перенапряжения. Разряд ионов гидроксония, приводящий к выделению молекулярного водорода, несмотря на простоту суммарного выражения процесса, является сложной электродной реакцией. Рассмотрим стадии этого процесса.
1. Диффузионная стадия. Электрохимический процесс протекает на электроде, поэтому необходима доставка ионов Н3О+ к поверхности, что осуществляется за счет переноса ионов и их диффузии. Отметим, что в данном случае эта стадия протекает без существенного торможения.
2. Стадия разряда протона с образованием адсорбированных атомов водорода (собственно электрохимический процесс):
Н3О+ + е = Надс + Н2О
3. Для стационарного протекания электролиза необходимо поддерживать постоянной поверхностную концентрацию атомов водорода, т.е. обеспечивать их непрерывный отвод с поверхности катода. Атомы водорода могут удаляться тремя путями: каталитической рекомбинацией, электрохимической десорбцией и эмиссией. При каталитическом механизме отвод атомов водорода происходит за счет их рекомбинации в молекулы с одновременной десорбцией:
Надс + Надс = Н2 (раств)
При электрохимической десорбции удаление атомов водорода с поверхности электрода происходит в результате разряда ионов гидроксония на уже адсорбированных атомах:
Н3О+ + Надс + е = Н2О + Н2 (раств)
При эмиссионном механизме адсорбированные атомы водорода испаряются с поверхности электрода в виде свободных атомов
Надс = Н
с их последующей объемной рекомбинацией в атомы водорода.
4. Молекулярный водород, образующийся из адсорбированного атомарного водорода, должен удаляться от границы раздела электрод–электролит в газовую фазу (в виде пузырьков газа).
|
|
|
Теории водородного перенапряжения различаются между собой по тому, какая из указанных стадий считается наиболее медленной и, следовательно, лимитирующей скорость общего электрохимического процесса. Некоторые из этих теорий представляют лишь исторический интерес; остановимся на тех, которые сохранили свое значение до настоящего времени
МЕТАЛЛЫ:
Электрохимическое выделение металлов из водных растворов их соединений лежит в основе гидроэлектрометаллургических процессов, т. е. процессов извлечения металлов из руд (электроэкстракция) и их очистки (рафинирование) при помощи электролиза. Гидроэлектрометаллургическим путём получают и очищают такие металлы, как медь, никель, цинк, кадмий, олово, свинец, серебро, золото, марганец и др. Гидроэлектрометаллургия позволяет получать технически чистые металлы и в ряде случаев вести успешную переработку бедных руд. Электрохимическое выделение металлов используется для защиты основного металла от разрушения при помощи покрытий из более устойчивых металлов или сплавов, а также для придания изделиям красивого, декоративного вида (гальванотехника).
Электролитическое выделение металлов чаще всего проводят из растворов их простых солей - сульфатов, хлоридов или нитратов. Суммарной катодной реакцией в этом случае будет разряд гидратированных металлических ионов с их последующим переходом в кристаллическую решётку образующегося на катоде осадка:
Mn+ × x H2O + n e - = [M] + x H2O
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 2419; Нарушение авторских прав?; Мы поможем в написании вашей работы!