
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мария Кедрова
|
|
|
|
Резюме
Формы выпуска и дозировка
Джосамицин зарегистрирован в России под торговыми названиями Вильпрафен (фирма Heinrich Mack, Германия) и Стомакс Солютаб (фирма Yamanouchi Europe, Голландия). Выпускается в следующих лекарственных формах:
· таблетки по 0,05, 0,2 и 0,5 г;
· суспензия во флаконах, содержащая 150 мг в 5 мл.
Джосамицин назначается внутрь независимо от приема пищи. Взрослым - 0,8-2 г/день в 2-3 приема. Детям: 30-50 мг/кг/день в 3 приема.
У больных циррозом печени дозу необходимо снижать.
Джосамицин является природным 16-членным макролидом, который, согласно данным контролируемых клинических исследований, наиболее эффективен при инфекциях нижних отделов дыхательных путей и урогенитальных хламидийных инфекциях. Препарат имеет следующие преимущества перед эритромицином:
· более устойчив в кислой среде;
· пища не снижает биодоступность;
· активен против эритромициноустойчивых штаммов S.pyogenes, S.aureus и коагулазонегативных стафилококков;
· действует на полирезистентные штаммы S.pneumoniae;
· реже вызывает нежелательные реакции;
· меньше взаимодействует с теофиллином.
РОКИТАМИЦИН*
Полусинтетическое 3’’-0-пропиониловое производное природного 16-членного макролида лейкомицина А5 (рис. 28). Разработан фармацевтической компанией Asachi Chemicals (Япония) в 1986 году. Широко используется в Японии, в том числе у детей, в виде сухого сиропа. Из европейских стран до последнего времени применялся только в Италии.
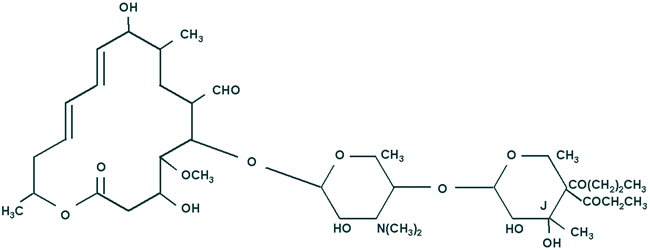
Рис. 28. Химическая структура рокитамицина
Рокитамицин является наиболее микробиологически активным среди 16-членных макролидов, в особенности против Legionella spp. и Mycoplasma spp. Действует на микроорганизмы, имеющие индуцибельную (но не конститутивную) резистентность к макролидам по MLS-типу. Активен против некоторых штаммов коагулазонегативных стафилококков и энтерококков, устойчивых к эритромицину [634].
|
|
|
Хорошо и быстро всасывается при приеме внутрь. Пиковая концентрация в сыворотке крови, равная 1,9 мг/л, развивается через 0,58 часа. В процессе биотрансформации образует два активных метаболита (лейкомицин А7 и 10’’-ОН-рокитамицин). Экскретируется преимущественно с желчью. Период полувыведения составляет 2 часа.
Имеются данные об эффективности рокитамицина при инфекциях дыхательных путей, кожи и мягких тканей, ородентальных инфекциях. Описаны случаи успешного применения препарата при глубоком шейном лимфадените у детей, вызванном C.psittaci [636].
* Не зарегистрирован в России
ЗАКЛЮЧЕНИЕ
Макролиды, история клинического применения которых насчитывает уже почти пятьдесят лет, представляют собой один из наиболее интересных и перспективных классов антибиотиков. Уникальность макролидов определяется прежде всего благоприятными фармакокинетическими свойствами, наиболее важным из которых является хорошее проникновение во многие ткани и органы и создание при этом высоких концентраций в клетках, что позволяет им действовать на внутриклеточные возбудители, такие как хламидии, микроплазмы, легионеллы, кампилобактеры, причем активность макролидов in vivo нередко бывает выше, чем in vitro. В этом заключается их существенное превосходство перед b-лактамными антибиотиками и аминогликозидами. Кроме того, макролиды способны проявлять активность против некоторых грамположительных кокков, резистентных к пенициллинам. Несомненным достоинством макролидов является хороший профиль безопасности, что существенно отличает их, например, от тетрациклинов, также хорошо проникающих внутрь клеток.
Особенно интенсивное изучение макролидов пришлось на 90-е годы, когда были разработаны и внедрены в клинику многие новые препараты с улучшенными микробиологическими и фармакокинетическими свойствами, появились подклассы азалидов и кетолидов. Целенаправленные исследования позволили уточнить некоторые элементы механизма антибактериального действия, закономерности развития резистентности микрофлоры, усовершенствовать методы определения ее чувствительности к макролидам. Выявлены такие важные в практическом отношении свойства, как активность в субингибирующих концентрациях и при длительном воздействии на возбудителя, влияние на функции нейтрофилов, иммунотропное и противовоспалительное действие.
|
|
|
В настоящее время макролидные антибиотики занимают одно из первых мест в мире по частоте клинического использования. Ежегодный объем их продажи составляет около 3 миллиардов долларов. Первоначально предлагавшиеся как альтернатива пенициллину, макролиды сейчас при многих инфекциях рассматриваются как основные антибиотики. Так, результаты многочисленных контролируемых клинических исследований позволяют считать макролиды препаратами выбора при внебольничной пневмонии у лиц с нормальным иммунным статусом. Эффективность макролидов при данной инфекции обусловлена их высокой активностью против "типичных" и "атипичных" возбудителей, а также способностью создавать высокие и стабильные концентрации в тканях и секретах нижних дыхательных путей. Дополнительное удобство макролидов, имеющих инъекционные лекарственные формы, заключается в том, что при тяжелых, требующих стационарного лечения формах пневмонии они могут назначаться ступенчатым курсом: сначала внутривенно, а затем внутрь. В особо тяжелых случаях макролиды могут применяться в сочетании с b-лактамными антибиотиками. Между ними не отмечается, как считали ранее, клинически значимого антагонизма.
Традиционными показаниями к применению макролидов являются также инфекции верхних отделов дыхательных путей (тонзиллофарингит), обострение хронического бронхита, ородентальные инфекции, инфекции кожи и мягких тканей, урогенитальные инфекции (особенно хламидийные). Причем, как свидетельствуют данные сравнительных клинических исследований, не выявлено существенных различий по эффективности при этих инфекциях между различными макролидами. Разработанные в последнее десятилетие рокситромицин, кларитромицин и азитромицин имеют превосходство перед первым из макролидов - эритромицином - главным образом по фармакокинетике и переносимости. Возможность меньшей кратности приема обеспечивает более высокую комплаентность лечению. В этой связи, на наш взгляд, представляется упрощенным разделять макролиды на "старые" и "новые", имея в виду только хронологию их разработки и появления на лекарственном рынке. Так, спирамицин, который всего "на два года моложе" эритромицина, по совокупности свойств ближе стоит к "новым" макролидам. По-видимому, истинно "старыми" препаратами следует считать только эритромицин и олеандомицин, уступающие другим макролидам по фармакокинетическим характеристикам и чаще вызывающие нежелательные лекарственные реакции.
|
|
|
Работы последних лет выявляют ранее неизвестные стороны действия макролидных антибиотиков, которые открывают новые возможности для их практического использования. Причем от первоначального универсализма в применении макролидов наблюдается переход к их дифференцированному назначению при отдельных инфекциях исходя из микробиологических и фармакокинетических данных, подтвержденных контролируемыми клиническими исследованиями. Так, кларитромицин используется в гастроэнтерологии в комплексной терапии, направленной на эрадикацию Н.pylori. Получены данные о возможности применения с этой целью рокситромицина и азитромицина. Азитромицин и кларитромицин являются также наиболее эффективными среди макролидов для лечения оппортунистических инфекций у больных со СПИДом, вызванных атипичными микобактериями. Эритромицин до настоящего времени остается препаратом выбора при легионеллезе. Спирамицин наиболее широко среди макролидов применяется при криптоспоридиозе и токсоплазмозе, в том числе является препаратом выбора при токсоплазмозе у беременных. При хламидийной инфекции у беременных препаратами выбора остаются эритромицин и спирамицин. Перспективы макролидов связаны с появившимися в последнее время данными о роли некоторых внутриклеточных возбудителей в патогенезе ряда тяжелых заболеваний, которые ранее не связывались с какой-либо инфекцией. Так, в развитии атеросклероза и саркоидоза определенное значение придается С.рnеumoniae, в формировании и прогрессировании бронхиальной астмы - C.pneumoniae, M.pneumoniae и U.urealyticum. В этой связи начато проведение широкомасштабных эпидемиологических контролируемых клинических исследований макролидов при инфаркте миокарда и бронхиальной астме с целью определения возможности их применения в качестве базисной терапии этих заболеваний.
|
|
|
Будущее макролидных антибиотиков, без сомнения, будет очень захватывающим. Их применение позволит изжить представление об антибиотиках как о препаратах с узкой сферой использования и расширить диапазон показаний для их назначения.
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 379; Нарушение авторских прав?; Мы поможем в написании вашей работы!