
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементы второго начала термодинамики. Энтропия
Ответ: Элементы второго начала термодинамики: Первое начало термодинамики являясь законом сохранения энергии, рассматривает уже совершённые процессы, но не указывает: 1)на возможность протекания данного процесса в данных условиях, 2)на полноту его протекания, 3)на его направления. Но известно, что одни и те же реакции (то есть с одинаковым  ) в разных условиях могут протекать по-разному. H2(г)+ ½O2(г)=H2O(п),
) в разных условиях могут протекать по-разному. H2(г)+ ½O2(г)=H2O(п),  =-242 кДж. а)t<1000 OC; H2(г)+ ½O2(г)=>H2O(п) – мгновенно (со взрывом), б)t=1000-3000 OС, H2(г)+½O2(г)óH2O (обратимо равновесия). в)t>3500 OC H2(г)+½O2(г)
=-242 кДж. а)t<1000 OC; H2(г)+ ½O2(г)=>H2O(п) – мгновенно (со взрывом), б)t=1000-3000 OС, H2(г)+½O2(г)óH2O (обратимо равновесия). в)t>3500 OC H2(г)+½O2(г)  не идёт. Клаузиус (1841г) установил: Любая форма энергии может быть полностью превращена в тепловую энергию, но тепловая полностью в другие виды энергии не превращается. Первая формулировка 2 начала термодинамики: Не возможен процесс единственный результат которого было бы превращение теплоты в работу.
не идёт. Клаузиус (1841г) установил: Любая форма энергии может быть полностью превращена в тепловую энергию, но тепловая полностью в другие виды энергии не превращается. Первая формулировка 2 начала термодинамики: Не возможен процесс единственный результат которого было бы превращение теплоты в работу.
Энтропия: Исследуя выражение для КПД Клаузиус ввёл новую термодинамическую функцию – энтропию. При химическом процессе – происходит как изменение энергии системы, так и изменение порядка расположения частиц относительно друг друга. Всем частицам (молекулам, атомам, ионам…) присуще стремление перейти в состояние с большим беспорядком в расположении. Мерой беспорядка хаотичности в расположении частиц в системе и является энтропия (S). Чем больше беспорядок в расположении частиц, тем больше энтропия (S). В изолированной системе изменение энтропии определяется соотношением:  , где: К – постоянная Больцамана, или
, где: К – постоянная Больцамана, или 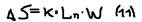 , где: W – вероятное состояния системы. Переход в систему из более упорядоченного состояния в менее упорядоченное (то есть с большим беспорядком в расположении) возможен самопроизвольно, т.к. он идёт с увеличением энтропии
, где: W – вероятное состояния системы. Переход в систему из более упорядоченного состояния в менее упорядоченное (то есть с большим беспорядком в расположении) возможен самопроизвольно, т.к. он идёт с увеличением энтропии  . Если
. Если  - возможен самопроизвольный процесс.
- возможен самопроизвольный процесс.  - не возможен самопроизвольный процесс.
- не возможен самопроизвольный процесс. 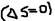 - равновесие (реакция обратима). В изолированных системах:
- равновесие (реакция обратима). В изолированных системах: 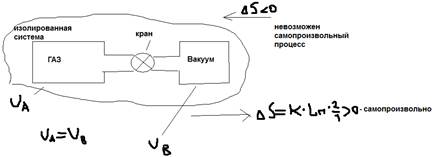 Современный формулы 2 начала термодинамики: В изолированной системе самопроизвольные процессы протекают в сторону увеличения энтропии
Современный формулы 2 начала термодинамики: В изолированной системе самопроизвольные процессы протекают в сторону увеличения энтропии  . Однако: в неизолированных системах самопроизвольные процессы могут протекать и с уменьшением энтропии
. Однако: в неизолированных системах самопроизвольные процессы могут протекать и с уменьшением энтропии 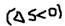 . Например: самопроизвольное охлаждение расплавленного металла на открытом воздухе
. Например: самопроизвольное охлаждение расплавленного металла на открытом воздухе  . В химических реакция под изменением энтропии можно судить по изменению объёма системы: Если V продукции реакции больше объёма исходного вещества, то энтропия увеличивается (жидкое и твёрдое вещество не учитывается). C(г)+O2(г)=2CO(г),
. В химических реакция под изменением энтропии можно судить по изменению объёма системы: Если V продукции реакции больше объёма исходного вещества, то энтропия увеличивается (жидкое и твёрдое вещество не учитывается). C(г)+O2(г)=2CO(г),  =2Vсo-Vo2=1 т.е.
=2Vсo-Vo2=1 т.е.  В общем случае:
В общем случае:  , где: ni, mi – коэффициент, Sорб – справочник. Пример: СO(г)+H2O(ж)=CO2(г)+H2(г), будет ли эта реакция протекать самопроизвольно? SO298, Дж/моль*К; CO=198, СO2=214, H2O=70, H2=130.
, где: ni, mi – коэффициент, Sорб – справочник. Пример: СO(г)+H2O(ж)=CO2(г)+H2(г), будет ли эта реакция протекать самопроизвольно? SO298, Дж/моль*К; CO=198, СO2=214, H2O=70, H2=130. 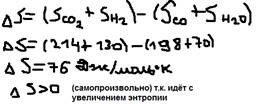
|
|
Дата добавления: 2015-04-24; Просмотров: 726; Нарушение авторских прав?; Мы поможем в написании вашей работы!