
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа
|
|
|
|
Ответ: Первый закон Рауля:  При растворении какого-либо нелетучего вещества в растворителе, активная поверхность испаренная уменьшается из-за того, что часть её будет занята молекулами растворителя вещества. В результате будет уменьшаться испарение растворителя, а значит будет и уменьшаться пропорционально давление его парод над раствором. p0 – давление паров растворителя над чистым раствором, p – давление паров растворителя над раствором, p0-p - понижение давления насыщенности пара растворителя над раствором, p-p0 – относительное понижение давления. 1 закон Рауля: относительное понижение давления насыщенности пара растворителя над раствором прямо пропорционально молярной доле раствора вещества:
При растворении какого-либо нелетучего вещества в растворителе, активная поверхность испаренная уменьшается из-за того, что часть её будет занята молекулами растворителя вещества. В результате будет уменьшаться испарение растворителя, а значит будет и уменьшаться пропорционально давление его парод над раствором. p0 – давление паров растворителя над чистым раствором, p – давление паров растворителя над раствором, p0-p - понижение давления насыщенности пара растворителя над раствором, p-p0 – относительное понижение давления. 1 закон Рауля: относительное понижение давления насыщенности пара растворителя над раствором прямо пропорционально молярной доле раствора вещества: 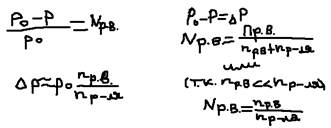 Задача: Расчёт растворимости насыщенности водяного парад на 9% раствора глюкозы при 100 OС.
Задача: Расчёт растворимости насыщенности водяного парад на 9% раствора глюкозы при 100 OС.  2 Закон Рауля: Всякая жидкость начинает кипеть при той температуре, при которой давление её насыщенности пара достигает величины внешнего давления (так H2O при 760 мм. рт. ст. кипит при 100 OC потому, что при этой температуре давление её насыщенности пара как раз равна 760 мм. рт. ст). Если растворять в воде какое-нибудь нелетучее вещество, то давление её пара понизится (1 закон Рауля). Чтобы достичь давления пара над раствором 860 мм. рт.ст. раствор нужно нагреть до температуры более 100 OС. Отсюда следует, что растворы всегда кипят при более высокой температуре, чем чистый раствор, а замеряют при более низкой температуре чем чистый раствор. Повышение температуры кипения:
2 Закон Рауля: Всякая жидкость начинает кипеть при той температуре, при которой давление её насыщенности пара достигает величины внешнего давления (так H2O при 760 мм. рт. ст. кипит при 100 OC потому, что при этой температуре давление её насыщенности пара как раз равна 760 мм. рт. ст). Если растворять в воде какое-нибудь нелетучее вещество, то давление её пара понизится (1 закон Рауля). Чтобы достичь давления пара над раствором 860 мм. рт.ст. раствор нужно нагреть до температуры более 100 OС. Отсюда следует, что растворы всегда кипят при более высокой температуре, чем чистый раствор, а замеряют при более низкой температуре чем чистый раствор. Повышение температуры кипения: 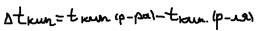 . Понижение температуры замерзания:
. Понижение температуры замерзания:  2 закон Рауля: повышение температуры кипения или понижение температуры кристаллического раствора, прямо пропорционально молярной концентрации растворителя вещества:
2 закон Рауля: повышение температуры кипения или понижение температуры кристаллического раствора, прямо пропорционально молярной концентрации растворителя вещества:  , где: Кэ – эбулиоскопическая постоянная, Кк – криоскопическая постоянная.
, где: Кэ – эбулиоскопическая постоянная, Кк – криоскопическая постоянная.  Кэ, Кк – зависят только от природы растворителя но не зависят от природы раствора вещества. Для воды: Кэ=0,52 OC; Кк=1,86 OC. Примеры: Задача №1: Определить температуру замерзания антифриза.
Кэ, Кк – зависят только от природы растворителя но не зависят от природы раствора вещества. Для воды: Кэ=0,52 OC; Кк=1,86 OC. Примеры: Задача №1: Определить температуру замерзания антифриза. 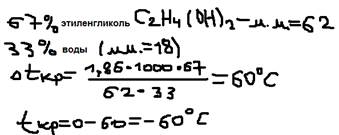 Задача №2: При растворении 2,76 гр. Глицерина в 200 гр. Воды температура замерзания понизилась на 0,28 OС. Определить молярную массу глицерина.
Задача №2: При растворении 2,76 гр. Глицерина в 200 гр. Воды температура замерзания понизилась на 0,28 OС. Определить молярную массу глицерина. 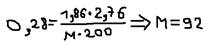
|
|
|
Осмотическое давление. Закон Вант-Гоффа: Осмос – это диффузия молекулы растворителя в растворе через полупроникцаемости перегородку (то есть проницаемости для молекулы растворителя, но не проницаемости для молекул раствора вещества). Раствор сахара в воде: 
 Осмотические силы отнесённые к единицам площади их действия называются осмотическим давлением: P/S=Pосм. Закон Вант-Гофа: Осмотическое давление равно тому давление, которое оказывал бы раствор вещества, если бы оно находилось в газообразном состоянии и занимало объём раствора.
Осмотические силы отнесённые к единицам площади их действия называются осмотическим давлением: P/S=Pосм. Закон Вант-Гофа: Осмотическое давление равно тому давление, которое оказывал бы раствор вещества, если бы оно находилось в газообразном состоянии и занимало объём раствора.  Если: Pосм=атм, V=литры, Pосм.=мм.рт.ст., V-мл, R=62400 мм.рт.ст.*мл/моль*К, то: R=0,082 л*атм/моль*К (чаще всего). Pосм.=Па, V=м3, R=8,314 Дж/моль. Пример: Ст=1 моль/л, Pосм.=1*0,082*273=22,4 атм. Осмос играет большую роль в биологических процессах обеспечивает поступление воды в клетки и другие структуры. Растворы с одинаковым Pосм. Называются изотоническими. Если Pосм. 1-ми внутриклеточными то называются гипертоническими, а ниже – гипотоническими. Гипертонический раствор сахара (сиропы) и NaCl используются для консервирования продуктов т.к. вызывают удаление воды из микроорганизмов, то есть их обезвоживание и гибель.
Если: Pосм=атм, V=литры, Pосм.=мм.рт.ст., V-мл, R=62400 мм.рт.ст.*мл/моль*К, то: R=0,082 л*атм/моль*К (чаще всего). Pосм.=Па, V=м3, R=8,314 Дж/моль. Пример: Ст=1 моль/л, Pосм.=1*0,082*273=22,4 атм. Осмос играет большую роль в биологических процессах обеспечивает поступление воды в клетки и другие структуры. Растворы с одинаковым Pосм. Называются изотоническими. Если Pосм. 1-ми внутриклеточными то называются гипертоническими, а ниже – гипотоническими. Гипертонический раствор сахара (сиропы) и NaCl используются для консервирования продуктов т.к. вызывают удаление воды из микроорганизмов, то есть их обезвоживание и гибель.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1736; Нарушение авторских прав?; Мы поможем в написании вашей работы!