
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура солей. Название кислых, средних и основных солей
Классификация, получение и свойства солей
Классификация, получение и свойства оснований
Экономически активное население (ЭАН) – совокупность лиц в возрасте, определённом для данной категории ТР, предлагающих свою рабочую силу для производства товаров и услуг, 15 – 72 лет (МОТ).
Международный стандарт – 15 - 60
Женщины – 16 – 54 лет
Мужчины – 16 – 59 лет
3. самодеятельное население – лица, имеющие источники средств к существованию, независимо от их участия в общественном производстве.
4. Экономически активное население (ЭАН) – совокупность лиц в возрасте, определённом для данной категории ТР, предлагающих свою рабочую силу для производства товаров и услуг, 15 – 72 лет (МОТ).
ЭАН изучается на основе выборочных обследований, которые проводятся в России с середины 90-х годов по методологии МОТ (Международная Организация Труда) в ноябре.
Билет №39. Экономически активное население страны: определение, характеристика структуры.
Экономическое население состоит из двух больших групп: занятых и безработных.
Занятые – это:
1. лица, выполняющие в рассматриваемом периоде работу, приносящую доход.
2. временно отсутствующие на работе
3. занятые в домашнем хозяйственном производстве товаров и услуг для их реализации
Безработные – это:
1. лица, не имеющие работы на момент обследования
2. лица, занимающиеся поиском работы
3. лица, готовые приступить к работе при её наличии
Показатели ЭАН:
1. Численность ЭАН страны в динамике на конкретную дату
2. Среднегодовая численность ЭАН страны
3. Уровень ЭАН:
 (%)
(%)
| Годы | Численность ЭАН России (млн. чел.) |
| 72,3 | |
| 71,4 | |
| 72,4 | |
| 72,8 | |
| 72,9 | |
| 73,8 | |
| 74,2 |
Билет №40. Статистическое изучение занятости и безработицы.
Трудовые ресурсы включают в себя трудоспособное население в трудоспособном возрасте, а также находящихся за его пределами работающих лиц (пенсионеров, подростков).
Трудоспособный возраст в РФ:
· для мужчин – от 16 до 59;
· для женщин – от 16 до 54.
Численность граждан России, выезжающих на работу за границу, не исключается из численности трудовых ресурсов региона, но не участвует в формировании численности населения, участвующего в экономике.
Показатели демографической нагрузки:
· коэффициент потенциального замещения (отношение численности детей (от 0 до 15) к общей численности трудовых ресурсов);
· коэффициент «пенсионной» нагрузки (отношение численности населения пенсионного возраста к общей численности трудовых ресурсов);
· коэффициент общей нагрузки (отношение суммы численности детей до 15 лет и пенсионеров к общей численности трудовых ресурсов).
Трудовые ресурсы – это часть населения, потенциально способная работать, но не обязательно вовлеченная в производительный процесс.
Экономически активные лица – лица в возрасте, установленном для измерения экономической активное население активности населения (от 15 до 72 лет), обеспечивающие предложение рабочей силы для производства товаров и услуг. В его состав входят занятые и безработные. (КЭАН = занятые + безработные)
Коэффициент занятости:

К занятым в экономике относятся лица обоего пола в возрасте от 16 лет и старше, а также лица младших возрастов, которые в рассматриваемый период:
1) выполняли работу по найму за вознаграждение на условиях полного либо неполного рабочего времени, а также любую приносящую доход работу самостоятельно или у отдельных граждан независимо от сроков получения непосредственной оплаты или дохода за свою деятельность.
2) временно отсутствовали на работе из-за травмы или болезни, ухода за больными, ежегодного отпуска или выходных дней, работы по специальному графику, установленного законом отпуска по беременности, родам и уходу за ребенком, обучении, учебного отпуска и т.д.
3) Осуществляли работу без оплаты на семейном предприятии.
Уровень экономически активного населения – это соотношение численности экономически активного населения (ЭАН) к общей численности населения страны на определенную дату (Sобщ):
Вместо общей численности населения может быть использована численность трудовых ресурсов (ТР):

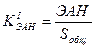 Коэффициент безработицы:
Коэффициент безработицы:

К безработным согласно МОТ относятся лица в возрасте, установленном для измерения экономической активности, которые в рассматриваемый период одновременно соответствуют критериям:
1) не имеют работы;
2) занимаются поиском работы;
3) готовятся приступить к работе.
Учащихся, студентов, пенсионеров и инвалидов учитывают в качестве безработных, если они занимались поиском работы и были готовы приступить к ней.
Безработными по Закону о занятости населения в РФ не могут быть признаны граждане:
· не достигшие 16 лет;
· получающие трудовые пенсии по старости, в том числе досрочно и за выслугу лет;
· нарушившие порядок регистрации в качестве безработного.
Для сравнительной характеристики по регионами динамических сопоставлений данных о численности безработных (Б) рассчитываются 2 коэффициента:
¾ уровень безработицы (МОТ) – удельный вес численности безработных в численности экономически активного населения:
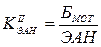
¾ уровень официально зарегистрированной безработицы (ОФ) – удельный вел численности официально зарегистрированных безработных в численности экономически активного населения:

Билет №41. Показатели наличия рабочей силы на предприятиях: списочный и явочный составы, средние показатели списочного состава работников.
Основным источником информации о численности занятых в экономике являются данные о численности работников, получаемые от предприятий. На уровне предприятия для определения численности работников на конкурентную дату или в среднем за период используют показатели списочной, средней и среднесписочной численности работников.
Списочная численность работников – это моментный показатель, определяемый на конкурентную дату. В нее входят наемные работники по трудовому договору (контракту), а также собственники организации, работавшие в ней и получавшие заработную плату.
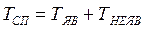 Списочная численность (TСП) работников за каждый календарный день состоит из явившихся на работу (TЯВ) и отсутствующих по каким-либо причинам (ТНЕЯВ).
Списочная численность (TСП) работников за каждый календарный день состоит из явившихся на работу (TЯВ) и отсутствующих по каким-либо причинам (ТНЕЯВ).
В списочную численность целыми единицами включаются работники:
1) фактически явившиеся на работу (работающие на предприятии иностранцы, принятые на неполный рабочий день или на неполную ставку);
2) не явившиеся на работу по ряду причин (отпуск, болезни, выполнение государственных обязанностей, забастовка, обучение с отрывом от производства и т.д.).
В списочную численность не включаются работники:
1) принятые на работу по совместительству из других организаций;
2) выполнявшие работу по договорам гражданско-правового характера;
3) привлеченные для работы в организациях;
4) направленные на работу в другую организацию;
5) 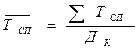 направленные организациями на обучение и получающие стипендию за счет средств других организаций;
направленные организациями на обучение и получающие стипендию за счет средств других организаций;
6) подавшие заявление об увольнении;
7) неработающие собственники данной организации.
Среднесписочная численность работников за месяц вычисляется как сумма списочной численности работников (ТСП) за все календарные дни месяца, деленная на их число (Дk) (в выходные и праздничные дни она принимается равной списочной численности работников за предшествующий рабочий день).
Некоторые категории работников списочной численности не включаются в среднесписочную численность во избежание искажений в расчетах других экономических показателей:
1) женщины (отпуск по беременности, родам или дополнительном отпуске по уходу за ребенком);
2) работники (обучение в образовательных учреждениях, дополнительный отпуск без сохранения зарплаты);
3) лица, не состоящие в списочном составе и привлеченные для работы по специальным договорам;
лица, работавшие неполное рабочее время в соответствие с трудовым договором.
Формула средней арифметической из месячных данных (вычисляется среднесписочная численность работников за период более одного месяца).
Среднесписочную численность работников в организациях рассчитывают:
· неполный месяц - путем деления суммы численности работников списочного состава за все календарные дни работы в отчетном месяце на общее число календарных дней в нем;
· неполный квартал или год – путем суммирования среднесрочной численности работников за месяцы работы в отчетном периоде и деления полученной величины на три (или соответственно на 12).
Билет №42. Показатели движения рабочей силы на предприятиях, фирмах.
Процесс изменения численности работников, приводящих к перераспределению рабочей силы между отдельными предприятиями, отраслями и регионами, называется движением рабочей силы.
Одни из причин движения рабочей силы имеют демографический характер: вступление в трудоспособный возраст и уход на пенсию по достижении пенсионного возраста. Изменения, происходящие в экономике, приводят либо к сокращению рабочих мест либо созданию новых рабочих мест.
Списочный состав работников включает: численность работников всех категорий, принятых на постоянную, сезонную или временную работу на один день и более, получающих заработную плату на данном предприятии. Также:
n рассчитывается за каждый рабочий день (ежедневно);
n для праздничных и выходных дней используется списочный состав предыдущего рабочего дня;
n списочный состав рабочего дня складывается из явок и неявок на работу по разным причинам
Не учитываются в списочном составе (учитываются отдельно):
n внешние совместители;
n лица, работающие по договорам подряда;
n практиканты и стажёры;
n лица, направленные в командировки, на обучение без сохранения заработной платы;
n лица, выполняющие разовые специальные работы (консультации, экспертизу и т.д.)
Среднесписочная численность работников за месяц
Т мес. = сумма показателей списочного состава работников за каждый день работы предприятия в отчётном месяце/ число календарных дней месяца
Среднесписочная численность работников за квартал
Т кв.= сумма показателей среднесписочного состава работников за месяцы работы в квартале/ 3 (число месяцев квартала)
Среднесписочная численность работников за год
Тгод.= сумма показателей среднесписочного состава работников за месяцы работы предприятия в отчётном году/ 12 (месяцы года)
Показатели движения рабочей силы на предприятиях, фирмах.
· Абсолютные
1. Оборот по приёму на работу - число работников, принятых на работу в рассматриваемом периоде
2. Оборот по выбытию (увольнению) - число работников, уволенных с работы по всем причинам в рассматриваемом периоде
3. Общий оборот персонала - число работников, принятых на работу и уволенных с работы по всем причинам в рассматриваемом периоде
4. Необходимый оборот - число работников, уволенных по причинам:
1)Окончания срока договора найма, 2)Сокращения штатов, 3)Перехода на другое предприятие, 4)Призыва в армию, 5)Выхода на пенсию, 6)Смерти работника, 7)Реорганизации производства, 8)Поступления в учебное заведение дневной формы обучения и т.д.
5. Текучесть рабочей силы (излишний оборот) - число работников, уволенных по собственному желанию и за нарушения дисциплины
· Относительные
1. Коэффициент по приёму на работу
2. Коэффициент по выбытию
3. Коэффициент общего оборота
4. Коэффициент необходимого оборота
5. Коэффициент текучести (излишнего оборота)
Методика: все коэффициенты движения рабочей силы за исследуемый период рассчитываются методом деления соответствующего абсолютного показателя на среднесписочную численность работников и выражаются в процентах
Пример исчисления коэффициентов по приёму на работу и по выбытию
К оборота по приему = оборот по приему/ среднесписочная численность работников* 100(%)
К оборота по выбытию = оборот по выбытию/ среднесписочная численность работников* 100(%)
Для оценки ситуации с занятостью можно использовать:
·  коэффициент замещения рабочей силы (отношение числа принятых работников к числу уволенных за период либо как соотношение между коэффициентами оборота по приему и по выбытию):
коэффициент замещения рабочей силы (отношение числа принятых работников к числу уволенных за период либо как соотношение между коэффициентами оборота по приему и по выбытию):
В том случае:
Ø если этот коэффициент больше 1, то происходит не только возмещение убыли рабочей силы, но и появляются новые рабочие места;
Ø если этот показательно меньше 1, то это свидетельствует о том, что сокращаются рабочие места, и ситуация приводит к безработице, если речь идет об отдельном предприятии или обществе.
Для анализа степени стабильности трудовых коллективов может быть использован коэффициент постоянства состава:
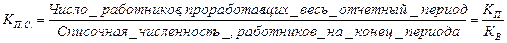
Данные о движении рабочей силы разрабатываются по предприятиям и организациям, по отраслям, территориальным единицам и по экономике в целом.
Билет №43. Натуральные индексы производительности труда.
Производительность труда – это результативность конкретного живого труда, эффективность целесообразной производительной деятельности по созданию продукта в течение определенного промежутка времени.
Задачи статистики производительности труда:
· Совершенствование методики расчета производительности труда
· Выявление факторов роста производительности труда
· Определение влияния производительности труда на изменение объема продукции
Индивидуальный натуральный индекс производительности труда iпр.тр.=(q1/T1)/(q0/T0)=w1/w0, где
q – кол-во произведенной продукции, Т – затраты времени на производство всей продукции или списочный состав работников, w=q/T – выработка продукции в единицу времени/одним работником.
Общие натуральные индексы:
1) Фиксированного (постоянного) состава Iпр.тр.пост.сост. = ∑iпр.тр.Т1/∑Т1 , где
Т1 – списочный состав работников или общие затраты рабочего времени на выпуск продукции
iпр.тр. – индивидуальный индекс производительности труда
На величину индекса производительности труда фиксированного (постоянного) состава влияет только изменение производительности труда по отдельным видам продукции/предприятиям.
2) Переменного состава Iпр.тр.перем.сост. = (∑q1/∑T1)/(∑q0/∑T1) = wср.1/wср.0, где
Wср – средняя выработка продукции в единицу времени/на 1 работника
На величину индекса производительности труда переменного состава влияют несколько факторов: изменение производительности труда по отдельным видам продукции/предприятиям, структурные сдвиги в производстве, т.е. изменения доли отдельных видов продукции в текущем периоде по сравнению с базисным.
3) Влияния структурных сдвигов на уровень производительности труда
Iстр.сдв. = Iпр.тр.перем.сост. / Iпр.тр.пост.сост.
Билет №44. Трудовые индексы производительности труда.
Индивидуальный трудовой индекс производительности труда iпр.тр.=(T1/q1)/(T0/q0)=t1/t0, где
q – кол-во произведенной продукции, Т – затраты времени на производство всей продукции или списочный состав работников, t= T/q – трудоемкость; затраты времени на производство единицы продукции/ число работников, приходящихся на единицу продукции.
Общие трудовые индексы:
1. Фиксированного (постоянного) состава Iпр.тр.пост.сост. = ∑t0q1/∑t1q1,
∑t0q1-∑t1q1 – экономия рабочего времени
2. Переменного состава Iпр.тр.перем.сост. = (∑T0/∑q0)/(∑ T1/∑q1) = tср.0/tср.1
3. Влияния структурных сдвигов на уровень производительности труда
Iстр.сдв. = Iпр.тр.перем.сост. / Iпр.тр.пост.сост.
Натуральные должны совпасть с трудовыми
Взаимосвязь индексов: Iзатрат раб. времени. = ∑T1/∑T0 = ∑t1q1/∑t0q1
Iфиз.объема продукции = Iпр.тр. * Iзатрат раб. времени.
Iтрудоемкости = 1/Iпр.тр.
Основаниями (основными гидроксидами) с позиции теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов ОН.
По современной номенклатуре их принято называть гидроксидами элементов с указанием, если необходимо, валентности элемента (римскими цифрами в скобках): КОН – гидроксид калия, гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, гидроксид хрома (II) – Cr(OH)2, гидроксид хрома (III) – Cr(OH)3.
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами - Li, Na, K, Cs, Rb, Fr, Ca, Sr, Ba и поэтому называемые щелочами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов ОН в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее, небольшие равновесные концентрации иона ОН даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
По числу гидроксильных групп (кислотность), способных замещаться на кислотный остаток, различают:
- однокислотные основания – KOH, NaOH;
- двухкислотные основания – Fe(OH)2, Ba(OH)2;
- трехкислотные основания – Al(OH)3, Fe(OH)3.
Получение оснований 1. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания: CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4, K2SO4 + Ba(OH)2 = 2KOH + BaCO3↓. При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль. При получении нерастворимых в воде оснований, обладающих амфотерными свойствами, следует избегать избытка щелочи, так как может произойти растворение амфотерного основания, например, AlCl3 + 3KOH = Al(OH)3 + 3KCl, Al(OH)3 + KOH = K[Al(OH)4]. В подобных случаях для получения гидроксидов используют гидроксид аммония, в котором амфотерные оксиды не растворяются: AlCl3 + 3NH4OH = Al(OH)3↓ + 3NH4Cl. Гидроксиды серебра, ртути настолько легко распадаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды: 2AgNO3 + 2KOH = Ag2O↓ + H2O + 2KNO3.
2. Щелочи в технике обычно получают электролизом водных растворов хлоридов: 2NaCl + 2H2O = 2NaOH + H2 + Cl2. (суммарная реакция электролиза) Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой: 2Li + 2H2O = 2LiOH + H2↑, SrO + H2O = Sr(OH)2.
Химические свойства оснований
1. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов: 2Fe(OH)3 = Fe2O3 + 3H2O,\ Ca(OH)2 = CaO + H2O.
2. Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:NaOH + HNO3 = NaNO3 + H2O, Cu(OH)2 + H2SO4 = CuSO4 + 2H2O.
3. Щелочи взаимодействуют с кислотными и с амфотерными оксидами: 2KOH + CO2 = K2CO3 + H2O, 2NaOH + Al2O3 = 2NaAlO2 + H2O.
4. Основания могут вступать в реакцию с кислыми солями:2NaHSO3 + 2KOH = Na2SO3 + K2SO3 +2H2O, Ca(HCO3)2 + Ba(OH)2 = BaCO3↓ + CaCO3 + 2H2O. Cu(OH)2 + 2NaHSO4 = CuSO4 + Na2SO4 +2H2O.
5. Необходимо особенно подчеркнуть способность растворов щелочей реагировать с некоторыми неметаллами (галогенами, серой, белым фосфором, кремнием):2NaOH + Cl2 = NaCl +NaOCl + H2O (на холоду),
6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O (при нагревании), 6KOH + 3S = K2SO3 + 2K2S + 3H2O, 3KOH + 4P + 3H2O = PH3↑ + 3KH2PO2, 2NaOH + Si + H2O = Na2SiO3 + 2H2↑.
6. Кроме того, концентрированные растворы щелочей при нагревании способны растворять также и некоторые металлы (те, соединения которых обладают амфотерными свойствами):2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑, Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2↑.
Растворы щелочей имеют рН 7 (щелочная среда), изменяют окраску индикаторов (лакмус – синяя, фенолфталеин – фиолетовая).
Наиболее сложными среди неорганических соединений являются соли. Они очень разнообразны по составу. Их делят на средние, кислые, основные, двойные, комплексные, смешанные. Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода и гидроксид-ионы. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов (или группами атомов): H2SO4 → NaHSO4 → Na2SO4, Или как продукты замещения гидроксогрупп в основном гидроксиде кислотными остатками: Zn(OH)2 → ZnOHCl → ZnCl2. При полном замещении получаются средние (или нормальные) соли: Ca(OH)2 + H2SO4 = CaSO4 + 2H2O.
При растворении средних солей образуются катионы металла и анионы кислотного остатка: Na2SO4 →2Na+ + SO42. При неполном замещении водорода кислоты получаются кислые соли: NaOH + H2CO3 = NaHCO3 + H2O. При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного остатка, в том числе ионы Н+: NaHCO3 →Na+ + HCO3 HCO3  H+ + CO32. При неполном замещении гидроксогрупп основания - основные соли: Mg(OH)2 + HBr = Mg(OH)Br + H2O. При растворении основных солей в растворе образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН: Mg(OH)Br → (MgOH)+ + Br, (MgOH)+
H+ + CO32. При неполном замещении гидроксогрупп основания - основные соли: Mg(OH)2 + HBr = Mg(OH)Br + H2O. При растворении основных солей в растворе образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН: Mg(OH)Br → (MgOH)+ + Br, (MgOH)+  Mg2+ + OH. Таким образом, в соответствии с данным определением, соли делятся на средние, кислые и основные. Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и один анион: CaCO3MgCO3 (доломит), KCl∙NaCl (сильвинит), KAl(SO4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: CaOCl2 (или CaCl(OCl)) – кальциевая соль соляной и хлорноватистой (HOCl) кислот (хлорид-гипохлорит кальция). Комплексные соли содержат комплексные катионы или анионы: K3+[Fe(CN)6]−3, K4+[Fe(CN)6]−4, [Cr(H2O)5Cl]2+Cl2−. Согласно современным номенклатурным правилам, названия солей образуются из названия аниона в именительном падеже и названия катиона в родительном падеже. Например FeS - сульфид железа (II), Fe2(SO4)3 - сульфат железа (III). Атом водорода, входящий в состав кислой соли, обозначается приставкой гидро- (NaHSO3 –гидросульфит натрия), а группа ОН – приставкой гидроксо- (Al(OH)2Cl – дигидроксохлорид алюминия).
Mg2+ + OH. Таким образом, в соответствии с данным определением, соли делятся на средние, кислые и основные. Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и один анион: CaCO3MgCO3 (доломит), KCl∙NaCl (сильвинит), KAl(SO4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: CaOCl2 (или CaCl(OCl)) – кальциевая соль соляной и хлорноватистой (HOCl) кислот (хлорид-гипохлорит кальция). Комплексные соли содержат комплексные катионы или анионы: K3+[Fe(CN)6]−3, K4+[Fe(CN)6]−4, [Cr(H2O)5Cl]2+Cl2−. Согласно современным номенклатурным правилам, названия солей образуются из названия аниона в именительном падеже и названия катиона в родительном падеже. Например FeS - сульфид железа (II), Fe2(SO4)3 - сульфат железа (III). Атом водорода, входящий в состав кислой соли, обозначается приставкой гидро- (NaHSO3 –гидросульфит натрия), а группа ОН – приставкой гидроксо- (Al(OH)2Cl – дигидроксохлорид алюминия).
Получение солей
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей уже было обсуждено выше (разд. 2, 3), к ним относятся:
1. Взаимодействие основных, кислотных и амфотерных оксидов друг с другом: BaO + SiO2 = BaSiO3, MgO + Al2O3 = Mg(AlO2)2, SO3 + Na2O = Na2SO4, P2O5 + Al2O3 = 2AlPO4.
2. Взаимодействие оксидов с гидроксидами (с кислотами и основаниями): ZnO + H2SO4 = ZnSO4 + H2O, CO2 + 2KOH = K2CO3 + H2O, 2NaOH + Al2O3 = 2NaAlO2 + H2O.
3. Взаимодействие оснований со средними и кислыми солями: CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4, K2SO4 + Ba(OH)2 = 2KOH + BaSO4↓. 2NaHSO3 + 2KOH = Na2SO3 + K2SO3 +2H2O, Ca(HCO3)2 + Ba(OH)2 = BaCO3↓ + CaCO3↓ + 2H2O. Cu(OH)2 + 2NaHSO4 = CuSO4 + Na2SO4 +2H2O.
4. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов: 2Mg + Cl2 = MgCl2.
Химические свойства солей.
| 1. С металлами | Cu + HgCl2 = CuCl2 + Hg, Zn + Pb(NO3)2 = Zn(NO3)2 + Pb. |
| 2. C кислотами | Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑, AgCl + HBr = AgBr↓ + HCl |
| 3. C солями | AgNO3 + NaCl = AgCl↓ + NaNO3, K2CrO4 + Pb(NO3)2 = KNO3 + PbCrO4↓. |
| 4. C основаниями | CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4, Ni(NO3)2 + 2KOH = Ni(OH)2 + 2KNO3. |
| 5. Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются: CaCO3 = CaO + CO2, 2Ag2CO3 = 4Ag + 2CO2 + O2, NH4Cl = NH3 + HCl, 2KNO3 = 2KNO2 + O2, 2FeSO4 = Fe2O3 + SO2 + SO3, |
.Номенклатура солейОбщая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла. Названия средних солей состоят из двух частей: названия аниона (кислотного остатка) в именительном падеже и катиона в родительном. Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой. Например, CuSO4 – сульфат меди (II); NaCl – хлорид натрия.
Названия кислых солей образуются добавлением к аниону приставки гидро-, и, если необходимо, то с соответствующим числительным. Например, NaHSO4 – гидросульфат натрия; KH2PO4 – дигидрофосфат калия.
Названия основных солей образуются добавлением к аниону приставки гидроксо-, и, если необходимо, то с соответствующим числительным. Например, AlOHSO4 – гидроксосульфат алюминия; Fe(OH)2Cl – дигидроксохлорид железа (III).
Названия двойных солей состоят из двух частей: названия аниона в именительном падеже и катионов в родительном. Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой. Например, KAl(SO4)2 – сульфат алюминия – калия; NH4MgPO4 – фосфат магния – аммония; (NH4)2Fe(SO4)2 – сульфат железа (II) – аммония.
Названия комплексных соединений состоят из двух частей: внутренней и внешней сферы, причем вся внутренняя сфера называется одним словом. Названия лигандов – анионов оканчиваются соединительной гласной -о-. При этом для одноэлементных анионов соединительная гласная -о-добавляется к корню названия элемента, например, Cl- – хлоро-, а для многоэлементных кислородсодержащих анионов соединительная гласная присоединяется к традиционным или систематическим названиям анионов, например, SO32- – сульфито-; ОН- – гидроксо-; CN- – циано-. Названия молекул, являющихся лигандами, оставляют без изменения, например, C2H4 – этилен; но Н2О называют аква-, NH3 – аммин-, СО – карбонил-.
При названии соединений с комплексным анионом комплексообразователь называют по-латински, добавляя суффикс -ат. Степень окисления комплексообразователя указывают римскими цифрами в скобках после названия комплексного аниона. Число лигандов обозначают с помощью греческих числительных: 1 – моно-, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Название катиона указывают в родительном падеже. Например, Na[Al(OH)4] – тетрагидроксоалюминат натрия; K3[Cu(CN)4] – тетрацианокупрат (I) калия; (NH4)2[Hg(NCS)4] – тетрароданомеркурат (II) аммония.
При названии соединений с комплексным катионом комплексообразователь называют по-русски в родительном падеже. Степень окисления комплексообразователя указывают римскими цифрами в скобках после названия. Название аниона указывают в именительном падеже. Например, [Ag(NH3)2]Cl – хлорид диамминсеребра (I); [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II); [Co(H2O)6]Br2 – бромид гексааквакобальта (II).
В названии комплексного соединения, состоящего только из внутренней сферы, степень окисления комплексообразователя не указывается, так как она однозначно определяется исходя из электронейтральности комплекса. Название комплексообразователя приводится по-русски в именительном падеже. Например, [Co(H2O)3F3] – трифторотриаквакобальт; [Cr(NH3)2Cl2] – дихлородиамминхром; [Pt(NH3)2Cl4] – тертахлородиамминпланита.
Многие соли имеют традиционные названия, например:Pb2(CO3)(OH)2 – свинцовые белила;KCr(SO4)2·12H2O – хромкалиевые квасцы; CuSO4·5H2O – медный купорос; NaHCO3 – сода питьевая; K4[Fe(CN)6] – желтая кровяная соль и др.
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков.Соли бывают средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Например: имеем серную кислоту H2SO4. Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3. Средние соли ортофосфорной кислоты H3PO4: К3PO4, Ca3(PO4)2, AlPO4. Средние соли в водных растворах диссоциируют всегда в одну ступень:NaCI Na+ + CI - Al2(SO4)3 2AI3+ + 3SO42-.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Кислые соли могут быть образованы только от многоосновных кислот.Хлороводородная кислота HCl кислых солей не имеет. Серная кислота H2SO4 образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2, Fe(HSO4)3. Фосфорная кислота Н3РО4 имеет два типа кислых солей: с анионами Н2РО4-, НРО42-.
Кислые соли диссоциируют ступенчато:KH2PO4 K+ + H2PO4-, H2PO4-  H+ + HPO42-, HPO42-
H+ + HPO42-, HPO42-  H+ + PO43-,
H+ + PO43-,
Кислые соли чаще всего образуются в избытке кислоты: Mg(OH)2 + 2H2SO4 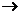 Mg(HSO4)2 + 2H2O. кислая соль Mg(OH)2 + H2SO4
Mg(HSO4)2 + 2H2O. кислая соль Mg(OH)2 + H2SO4 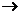 MgSO4 + 2H2O средняя соль
MgSO4 + 2H2O средняя соль
Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями.Гидроксиды щелочных металлов основных солей не имеют.
Гидроксиду меди Сu(ОН)2 соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4.
Гидроксид хрома (III) Cr(ОН)3 образует два ряда основных солей с катионами Cr(ОН)2+, CrОН2+:
|
|
Дата добавления: 2015-04-24; Просмотров: 868; Нарушение авторских прав?; Мы поможем в написании вашей работы!