
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация растворов. Способы выражения состава растворов
Энергия Гиббса. Соотношение между энергией Гиббса,энтальпией и энтропией. Стандартная энергия Гиббса образования вещества. Изменение энергии Гиббса в ходе реакции и направление самопроизвольного протекания реакции.
Факторы, определяющие направление самопроизвольного протекания химических процессов (энергетический и энтропийный).Энтропия. Второе и третье начала термодинамики. Определение изменения энтропии в ходе реакции.
Суть второго начала состоит в том, что оно определяет направление самопроизвольного протекания процессов, в том числе и химических реакций.
Самопроизвольным называется процесс, который протекает самостоятельно без воздействия внешних факторов.
Например, если соединить два сосуда — заполненный газом и пустой, то газ самопроизвольно заполнит весь объем. Взаимодействие металлического натрия с водой при н. у. также происходит самопроизвольно. Обратные процессы можно осуществить, оказав внешнее воздействие. Для исследователя необходимо иметь критерий, с помощью которого можно было бы предсказать направление самопроизвольного протекания процесса.
Существует еще одна функция состояния, которая с учетом первого начала термодинамики позволяет предсказать направление протекания процесса в изолированных системах. Такой функцией состояния является энтропия (S).
Интерпретировать энтропию можно как с точки зрения макроскопического состояния системы, так и с точки зрения микроскопического.
Если рассматривать систему в целом, то в обратимом процессе, протекающем при постоянной температуре, изменение энтропии будет равно:
D S = 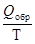
Для необратимого процесса это равенство превращается в неравенство:
D S> 
Второй закон термодинамики: В изолированной системе самопроизвольно протекают только те процессы, которыесопровождаются увеличением энтропии.
Третий закон термодинамики: Энтропия химических веществ при абсолютном нуле равна нулю. Энтропия – мера беспорядка.
Энергия Гиббса: РазностьD НТ - Т D SТ <0, представляет собой новую функцию состояния, так как является разностью двух функций состояния: энтальпии и энтропии, умноженной на температуру, которая, в свою очередь, подпадает под определение функции состояния. Называется эта функция свободной энергией Гиббса (или изобарно-изотермическим потенциалом), обозначается буквой Gи имеет размерность кДж/моль.
Изменение свободной энергии в процессе равно:D G = D Н-Т D S -S D T
Согласно первому началу термодинамики, изменение внутренней энергии системы равно сумме теплоты, выделенной или поглощенной в результате химической реакции или другого процесса, и полной работы, совершенной системой. Полная работа процесса, протекающего при постоянных давлении и температуре, складывается из работы против сил давления и полезной работы:
А = - р D V+Аполезн
D G = D U - Т D S+р D V
Изменения свободной энергии Гиббса:
D G = - р D V + Аполезн + Т D S+р D V - Т D S.
Физический смысл изменения свободной энергии Гиббса: Изменение свободной энергии равно максимальной полезной работе, которую совершает система в изобарно-изотермическом процессе.
Иными словами, это энергия, которую можно «изъять» из системы в виде полезной работы. Поэтому она и называется «свободной».
Понятие свободной энергии Гиббса является результатом единства первого и второго законов термодинамики.
Если изменение свободной энергии меньше нуля, то реакция протекает самопроизвольно.Если ∆G = 0, начальные и конечные состояния могут существовать в равновесии. Если же изменение свободной энергии больше нуля, самопроизвольное протекание реакции невозможно. Самопроизвольно протекает обратная реакция. стандартные изменения энтальпии и энтропии. Возможны четыре случая.
Первый: когда изменение энтальпии отрицательно, а изменение энтропии положительно, то изменение свободной энергии всегда отрицательно. Такие реакции самопроизвольно протекают в прямом направлении. Примером может служить реакция горения черного пороха, которая протекает по следующему суммарному уравнению:
2 КNO3 + 3С + S =N2 + ЗСО2 + К2S
Второй: когда изменение энтальпии положительно, а изменение энтропии отрицательно. Эти реакции в прямом направлении самопроизвольно не идут, самопроизвольно протекает обратная реакция. В качестве примера приведем реакцию термического разложения хлористого водорода на простые вещества:
2 НС1Г = Н2,г + С12,г
Изменение энтальпии этой реакции равно двум энергиям разрыва связей Н—С1 и составляет 92,3 х 2 = 184,6 кДж. Изменение энтропии равно:
DrS0298 = S0298 H2 + S0298 Cl2 - 2 S0298 HCl = 130,6 + 233 - 2ּ186,7 = -19.8 Дж/К
DrG0298 = 184,6 - 298× (-19,8) ×10~3 = 190,5 кДж > О
Третий: когда как изменение энтальпии, так и энтропии отрицательны. В этом случае направление самопроизвольного процесса определяется температурой. При низкой температуре самопроизвольно идет прямая реакция, так как по абсолютной величине изменение энтальпии больше произведения температуры на изменение энтропии. Например, в реакции образования хлорида аммония из газообразных хлористого водорода и аммиака:
NН3,г + НС1Г =NH4С1К
DгH0298 = D f H0298NH4Cl - D f H0298 Cl2 - D f H0298NH3 = -315,4-(-92,3)-(-46,2) = -176,9 кДж
DrS = S0298 NH4Cl - S0298 NH3 - S0298 HCl = 94,6 – 192,5 – 186,7 = -284,6 Дж/К
Т. к. при равновесии изменение свободной энергии равно нулю (DG = 0), то температура, при которой система находится в равновесии, равна

и
Т = 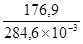 = 621,6К
= 621,6К
Четвертый: когда изменение энтальпии и энтропии положительные. Направление реакции также зависит от температуры: при низкой температуре самопроизвольно будет протекать обратная реакции, а при высокой — прямая.
Это характерно для реакций диссоциации:
N2O4«2 N02
Для данной реакции D г H0298 = 57,З кДж; D г S0298 = 1 76,6 Дж/К и DrG°298 = 4,7 кДж.
Температура, при которой устанавливается состояние равновесия: Т= 324,5 К. Ниже этой температуры самопроизвольно протекает реакция димеризации, а выше — реакция диссоциации.
Следует отметить, что стандартные величины образования изобарно-изотермического потенциала простых веществ (так же как и стандартные энтальпии образования простых веществ) принимаются равными нулю. Например: ΔfG0(H2) = 0.
30.Скорость химической реакции. Гомогенные и гетерогенные реакции. Факторы,определяющие скорость химических реакций. Закон действия масс. Константа скоростиреакции. Влияние температуры на скорость химических реакций. Энергия активации,активированный комплекс. Энергетическая диаграмма и тепловой эффект реакции.
Уравнение Аррениуса.
Скорость хим реакции -это число элем-х актов реакции, происход-х в ед. времени, в едV (для гомог-х), или на единице пов-ти раздела фаз (для гетер-х). Гомог-е – протек –т в однородной среде(в рас-ре, газ-й смеси). Гетер-е – протек на пов-ти раздела фазы. Напр: тв вещ-во – жидкость или газ. Факторы, влияющие на скор: 1. Природа реаг-х вещ-в; 2. Концентр-я; 3. Темп-ра; 4. Катализ-р; 5. Скорость диффузии(для гетер-х). Закон действия масс: при пост-й темп-ре скороть элем-й хим-й реакции прямопропорц-на концентр-иреаг-х вещ-в. Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения - правило Вант-Гоффа и уравнение Аррениуса. Правило Вант-Гоффа заключается в том, что при нагревании на 10 оС скорость большинства химических реакций увеличивается в 2 4 раза. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях намоль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:

k — константа скорости реакции, A — фактор частоты для реакции, R — универсальная газовая постоянная, T — температура в кельвинах.
31. Катализ и катализаторы. Гомогенные и гетерогенные катализаторы.
Влияние катализаторов на величину энергии активации и константу скорости реакции.
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.Катализаторы имеют ряд общих характерных особенностей:
1. Катализатор не влияет на общую стехиометрию реакции, он принимаетхимическое участие в процессе, расходуется на одной стадии и регенерируется надругой.
2. Катализатор уменьшает энергию активации реакции, благодаря чемуувеличивается ее скорость Катализатор не влияет на константу равновесия, он только сокращаетвремя достижения равновесия, одинаково увеличивая скорость прямой и обратной
реакций
32.Понятие о механизме химических реакций. Простые и сложные реакции, применение закона действия масс к простым и сложным реакциям. Кинетический порядок и молекулярность
реакций. Цепные реакции: зарождение, развитие, и обрыв цепи (на примере
неразветвленной цепной реакции водорода и хлора
Под механизмом химической реакции понимают те промежуточные реакции, которые протекают при превращении исходных веществ в продукты реакции. Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена. Примером химической реакции соединения может служить нагревание порошков железа и серы, - при этом образуется сульфид железа: Fe+S=FeS. Примером реакции разложение меже служить химичесмкая реакция разложения мела (илиизвестняка под воздействием температуры): СаСО3=СаО+СО2.Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в расвор медного купороса получаем железный капорос (здесь железо вытеснило медь из её соли) Fe+CuSO4= FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Прмеромхимичес койреакцииобмена может служить нейтрализация кислоты щёлочью: NaOH+HCl=NaCl+Н2О. Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко. Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
33.Химическое равновесие. Обратимые и необратимые химические реакции.
Константа химического равновесия. Факторы, определяющие величину константы.
Катализ и химическое равновесие. Сдвиг химического равновесия, принцип ЛеШателье
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А + В⇄ С + D.В состоянии равновесия скорости прямой и обратной реакции становятся равными. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:3H2 + N2 ⇆ 2NH3
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложениевзрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Принцип ЛеШателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление,концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.лияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
35.Растворы. Классификация дисперсных систем: истинные растворы, коллоидные
растворы, грубодисперсные системы
Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.В истинных растворах размер частиц менее 1×10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1×10−9 м — 5×10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа.Дисперсные системы, размер частиц в которых более 10-5 см называются грубодисперсными. К ним относят эмульсии, суспензии, порошки, пены.
35. Растворение как физико-химический процесс. Изменение энтропии, энтальпии и энергии
Гиббса при растворении веществ. Сольватация, сольваты. Тепловой эффект растворения.
Строение молекул воды и свойства воды как растворителя. Гидраты и кристаллогидраты.
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение изменения общего количества тепла Δ Q к величине абсолютной температуры T (то есть изменение тепла при постоянной температуре):  Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.. Свободная энергия Гиббса — этотермодинамический потенциал следующего вида Классическим определением энергии Гиббса является выражение
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.. Свободная энергия Гиббса — этотермодинамический потенциал следующего вида Классическим определением энергии Гиббса является выражение

где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами (в случае воды гидратами). В отличие от сольвиоза объединение однородных частиц в растворе называют ассоциацией. Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.Молекула воды является так называемой полярной молекулой, потому что ее положительный и отрицательный заряды не распределены равномерно вокруг какого-то центра, а размещены асимметрично, образуя положительный и отрицательный полюсы. В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его - сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, - по одному ядру водорода.В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.Она растворяет жидкие, твердые и газообразные вещества. Именно от этой особенности напрямую зависит жизнь всей нашей планеты. Ведь практически все газы, присутствующие в воздухе, растворимы в воде, что и обеспечивает всем водным организмам необходимый свободный кислород. Вода является хорошим растворителем, но не все вещества одинаково растворяются в воде. Хорошо растворяются в воде сахар, соль. Слабо растворяется в воде гипс. И практически не растворяются в воде хлорид серебра, сульфат бария.ч ГИДРАТЫ, продукты присоединения воды (гидратации)к молекулам, атомам или ионам. М. б. газообразными, жидкими и твердыми; последние наз.кристаллогидратами. \
36. н Растворимость веществ. Влияние природы растворяемого вещества и растворителя,
температуры и давления на растворимость газов, твердых и жидких веществ.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекулили частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Массовая доля (также называют процентной концентрацией)
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
 ,
,
где:
§ m1 — масса растворённого вещества, г (кг);
§ m — общая масса раствора, г (кг).
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации CM, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: термин «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. д.
 ,
,
где:
§ ν — количество растворённого вещества, моль;
§ V — общий объём раствора, л.
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
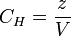 ,
,
где:
§ V — общий объём раствора, л;
§ z — число эквивалентности.
39.Электролиты и неэлектролиты. Свойства растворов неэлектролитов. Диффузия и осмос. Осмотическое давление(закон Вант-Гоффа). Давление пара раствора, зависимость от молярной доли. Температура кипения и замерзания раствора. Законы Рауля. растворяются в той или иной мере почти Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам - большинство органических соединений, а также Вещества,в молекулах которых имеются только ковалентные неполярные или малополярны.р О́смос (от греч. ὄσμος «толчок, давление») — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации. Диффузия (лат. diffusio — распространение, растекание, рассеивание) — процесс переноса материи или энергии из области с высокой концентрацией в область с низкой концентрацией (против градиента концентрации). Самым известным примером диффузии является перемешивание газов или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:

Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
где 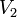 — скорость реакции при температуре
— скорость реакции при температуре 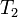 ,
,  — скорость реакции при температуре
— скорость реакции при температуре 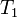 ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).Первый закон Рауля:Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).Первый закон Рауля:Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, ПА;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
|
|
Дата добавления: 2015-04-24; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!