
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы
|
|
|
|
(англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты с сопряженным основанием (напр., СН3СООН и CH3COONa — ацетатный буфер) или слабого основания и сопряженной кислоты (напр., NH3 и NH4CI — аммиачный буфер).[1] Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических и биохимических процессах.
Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в крови постоянство водородного показателя рН (химический гомеостаз) поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 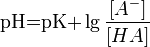 , где
, где 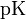 это отрицательный десятичный логарифм от константы диссоциации кислоты
это отрицательный десятичный логарифм от константы диссоциации кислоты  .
.
По сути  .
.
Действие буферных растворов наиболее эффективно, когда концентрации кислоты и основания одинаковы. У такого буфера максимальная буферная емкость - он наименее чувствителен к добавке сильной кислоты или сильного основания. Из формулы (7) следует, что если отношение концентрации основания к концентрации кислоты изменяется от значения 1: 1 до значения 10: 1 или 1: 10, то в обоих случаях рН изменяется на единицу. Этот интервал изменения отношений концентраций обычно принимают за максимально возможный для буферных растворов. Когда отношение концентраций подвергается большему изменению, мы говорим, что раствор потерял буферное действие. [ 1 ]
|
|
|
Действие буферных растворов можно объяснить, используя закон действующих масс. Рассмотрим в качестве примера буферное действие ацетатного буферного раствора, содержащего уксусную кислоту и ее соль - ацетат натрия. [ 2 ]
Действие буферных растворов основано на том, что отдельные компоненты буферных смесей связывают ионы водорода или гидроксила вводимых в них кислот или оснований с образованием слабых электролитов. [ 3 ]
Аналогичнодействие любого буферного раствора, содержащего слабую кислоту и ее соль, а также буферных растворов на основе солей слабых многоосновных кислот. [ 4 ]
Объяснениедействия буферных растворов основано на теорич электролитической диссоциации сильных и слабых электролитов. [ 5 ]
Объяснениедействия буферных растворов основывается на теории электролитической диссоциации сильных и слабых электролитов. [ 6 ]
Механизмдействия буферных растворов заключается в том, что введенные ионы лиония практически полностью прореагируют с основанием буферной лары, а введенные ионы лиата - с кислотой этой пары. При этом основание В превращается в кислоту А, и наоборот. [ 7 ]
Механизмдействия буферных растворов заключается в том, что введенные ионы лиония практически полностью прореагируют с основанием буферной пары, а введенные ионы лиата - с кислотой этой пары. При этом основание В превращается в кислоту А, и наоборот. [ 8 ]
Объяснениедействия буферных растворов основано на теории электролитической диссоциации сильных и слабых электролитов. [ 9 ]
Способдействия буферного раствора, например раствора уксусной кислоты, в присутствии ацетатного иона следующий: если водородный ион в виде сильной кислоты прибавляется к буферному раствору, ацетатный ион соединяется с ним, образуя уксусную кислоту. Поскольку уксусная кислота диссоциирует слабо, концентрация водородного иона не изменится в заметной степени. [ 10 ]
|
|
|
Рассмотрим механизмдействия буферных растворов. [ 11 ]
Рассмотрены теоретические основыдействия буферных растворов. Приведены состав, рН (или рН) и способы приготовления стандартных буферных растворов в водных, неводных, а также смешанных средах при различных температурах и давлении. Описаны буферные растворы для титриметрии, электронной спектрометрии, спектроскопии ПМР, полярографии, электрофореза, универсальные, двухфазные, биполярные буферные растворы общего назначения. Изложены требования, предъявляемые к реагентам, используемым для приготовления буферных растворов, и методы их очистки. [ 12 ]
Медленный рост рН вблизи тнлт мл [ уравнение (12.4.8) ] является основойдействия буферных растворов. Такие растворы поддерживают приблизительно постоянное значение рН при добавлении небольших количеств кислот или основании и играют жизненно важную роль в биологических процессах. [ 13 ]
Анализ уравнений (17) и (18) позволяет выяснить сущностьдействия буферных растворов. [ 14 ]
Первичные, вторичные и третичные амины, имеющие атом водорода в - положении по отношению к аминогруппе, подвергаются окислительному гидролизу до соответствующих альдегидов или кетонов поддействием буферного раствора К. [ 15 ]
Расчет рН буферных растворов
Буферными растворами называются растворы слабых кислот и их солей и слабых оснований и их солей, в которых, при добавлении небольших количеств кислот или оснований, концентрации ионов водорода (и pH) меняются незначительно. Достаточно широко применяются ацетатные буферные растворы, состоящие из уксусной кислоты и ее солей, аммиачные — состоящие из водного раствора аммиака и его солей.
В буферных растворах, состоящих из кислот и их солей, pH имеет порядок pK a ± 0,6. Достаточно точно величину pH можно рассчитать по формулам
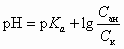 или
или 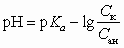 ,
,
где p Ka — отрицательный логарифм константы диссоциации кислоты; C ан — концентрация аниона кислоты моль/л, а С к — концентрация кислоты, моль/л.
На основе фосфорной кислоты и ее солей можно приготовить фосфатные буферные растворы, имеющие pH1 ≈ p K 1 = 2,12 (состав: H3PO4 и KH2PO4); pH2 ≈ p K 2 = 7,21 (состав: KH2PO4 и Na2HPO4); pH3 ≈ ≈ p K 3 = 12,36 (состав: Na2HPO4 и Na3PO4). Из фосфатных буферных растворов наиболее часто применяются растворы с pH ≈ 7. Однако фосфатные буферные растворы имеют тот существенный недостаток, что многие ионы металлов образуют с фосфат-ионами осадки малорастворимых солей.
|
|
|
Для аммиачного буферного раствора pH рассчитывают по формулам:
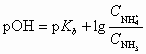 ;
; 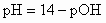 ;
; 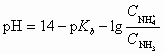 .
.
Для точных расчетов pH буферных растворов можно рекомендовать введение коэффициентов активностей, так как константы диссоциации слабых кислот, как правило, термодинамические.
Описанные в настоящем справочнике буферные растворы применяются в основном для градуировки
pH-метров. Эти растворы, приготовленные в полном соответствии с описанием, имеют заданную величину pH.
Методика приготовления буферных растворов основана на смешивании некоторых стандартных растворов определенного состава.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2578; Нарушение авторских прав?; Мы поможем в написании вашей работы!