
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Всякая изолированная система самопроизвольно стремится принять состояние, характеризующееся максимальной термодинамической вероятностью
Термодинамическая система. Первый закон термодинамики. Энтальпия. Закон Гесса. Стандартные энтальпии образования и сгорания веществ Тепловои эффект химической реакции. Стандартные условия. Термодинамическая функция состояния.
Кристаллы. Свойства кристаллических веществ. Элементарные ячейки кубической системы и их характеристики. Виды связи в кристаллах. Атомные, молекулярные, ионные, металлические кристаллы. Примеры.
Метод молекулярных орбиталей. Связывающие и разрыхляющие молекулярные орбитали. Энергетические диаграммы гомоядерных двухатомных молекул. Порядок (кратность) связи. Магнитные свойства молекул (рассмотреть на примере).
Ковалентная связь. Механизм ее образования(обменй и донорно-акцепторный) Метод валентных связей. Гибридизация атомных орбиталей. Полярность связи. Электрический момент связи и молекулы. Геометрическая форма молекул.
Химическая связь. Зависимость потенциальной энергии от межъядерного расстояния в двухатомной молекуле. Виды химической связи. Основные характеристики химической связи: длина, энергия, кратность связи, валентный угол. Водородная связь.
Периодический закон Д. И. Менделеева. Периодическое изменение физических и химических свойств элементов. Основные энергетические характеристики атома: энергия ионизации, сродство к электрону. Электроотрицательность. Закономерности их изменения в периодической системе элементов.
Строение многоэлектронных атомов. Принцип наименьшей энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Электронные и электроно - графические формулы атомов элементов в основном и возбужденных состояниях.
В многоэлектронных атомах, как и в атоме водорода, состояние каждого электрона можно характеризовать квантовыми числами. Межэлектронное отталкивание приводит к тому, что энергия электронов, имеющих одно и то же значение n, но разные значения l, становится различной. Последовательность заполнения е подуровней определяется принципом наименьшей энергии, принципом Паули и правилом Хунда.
Принцип наименьшей энергии: заполнение электронами АО происходит в порядке возрастания их энергии. Установлена энергетическая диаграмма для различных АО в много-е нейтральных атомов, находящихся в основном состоянии(с наименьшей энергией). Правило Клечковского: энергия АО возрастает в соотв. с увеличением n+l. При одинаковом значении суммы энергия меньше у АО с меньшим значением n.
Принцип Паули: в атоме не м.б. 2 е с одинаковым значением 4х квантовых чисел. Этот набор значений полностью определяет энергетическое состояние е. 2 е, находящихся на одной АО называются спаренными. Общее число орбиталей на эн. уроне со зн. n = n*2. Следовательно, max электронная емкость = 2n*2.
Правило Хунда определяет последовательность заполнения АО е в пределах одного подуровня и гласит: При данном значении l (в пределах 1 подуровня) в основном состоянии электроны располагаются т.о., что значение суммарного спина атома max(на подуровне должно быть max число неспаренных e).
Распределение е по разл. АО называют е конфигурацией атома. Эл. конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям. ЭК атома изображают 2мя способами: в виде е формул и е-графических диаграмм. При написании е формул используют n и l. Подуровень обозначают с помощью n и l(буквой). Число е на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода:  В случае е-графических диаграмм распределение е по подуровням представляют в виде квантовых ячеек. Орбиталь принято изображать квадратом, около кот. проставлено обозн. подуровня. Подуровни на каждом уровне д.б. немного смещены по высоте (энергия различна). Электроны изображаются против. стрелками в завис. от значения спина.С учетом структуры ЭК атомов все известные Эл. в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на 4 группы: s, p, d и f-элементы.
В случае е-графических диаграмм распределение е по подуровням представляют в виде квантовых ячеек. Орбиталь принято изображать квадратом, около кот. проставлено обозн. подуровня. Подуровни на каждом уровне д.б. немного смещены по высоте (энергия различна). Электроны изображаются против. стрелками в завис. от значения спина.С учетом структуры ЭК атомов все известные Эл. в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на 4 группы: s, p, d и f-элементы.
Отклонения от правила n+l наблюдаются у нек. элементов – это связано с тем, что с увеличением главного квантового числа различия между энергиями подуровней уменьшаются.
В настоящее время ПЗ формулируется: свойства хим. элементов, а также форма и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. Каждый из периодов (исключая первый) начинается типичным металлом (щелочной группы) и заканчивается инертным газом.
В периоде, с увеличением заряда ядра наблюдается изменение св-в от металлических к типично неметаллическим, что связано с увеличением числа е на внешнем энергетическом уровне.
В Группах объединены элементы, имеющие сходное е строение внешнего эн. уровня. Эл-ты аналоги (в 1 группе) проявляют схожие хим. св-ва. Т.о., при послед. увеличении зарядов атомных ядер периодически повторяется конфигурация ЭО и, как следствие, периодически повторяются хим. св-ва элементов. В этом заключается физ. смысл периодического закона.
Номер группы, как правило, указывает на число е, способных участвовать в образовании хим. связей (валентные электроны). – физический смысл номера группы.
Важнейшие характеристики атомов: размеры, энергия ионизации, сродство к электрону, электроотрицательность.
Атомные радиусы - Орбитальные радиусы атомов изменяются периодически. В периодах, по мере роста заряда ядер ОР уменьшаются (при одинаковом числе эн. уров. в периоде возрастает заряд ядра, а след., и притяжение е к ядру.). В группах с ростом заряда ядер ОР атомов увеличиваются. В главных подгруппах такое увел. происх. в большей степени.
Энергия ионизации – минимальная Е, которую требуется затратить на то, чтобы удалить данный е с АО невозбужденного атома на б.б. расстояние от ядра без сообщения ему кин. Е. (Э+Е->Э*+ + е), Е – в кДж/моль. Е хар-ет спос. ат. удерж. е – важная хар-ка его хим. акт-ти. Для много-е атомов можно рассматривать несколько Е, соотв-х Е отрыва 1,2, 3… е. (в периодах Е увел, в группах уменьшается). Потенциал ионизации –разность потенциалов, под воздействием которой е обретает Е, соотв. Е ионизации, измеряют в вольтах.
Сродство к е атома – энергия, которая выделяется (или затрачивается) при присоединении в нейтральному атому е с образованием отрицательного иона: Э+е->Э*- + Е, в кДж/моль. Сродство к е считают положительным, если присоед. сопр. выделением Е и наоборот. Зависит от е стр-ры атома. Наибольшим сродством обладают Эл. гр. VIIA (галогены). В подгруппах сверху вниз уменьшается, но не всегда монотонно.
Электроотрицательность. Это способность атома в молекуле или сложном ионе притягивать к себе е, учавствующие в образовании хим. связи.
В периоде эо аозрастает с увеличением порядкового номера, а в группе, как правило, убывает по мере увеличения ядра. Т.о. наим эо – s-эл. 1-ой группы, наиб. – p-эл-ты 6, 7 групп.
Химическая связь – совокупность взаимодействий атомов, приводящая к образованию устойчивых систем (молекул, комплексов, кристаллов.). Она возникает, если в результате перекрывания е облаков атомов происходит уменьшение полной энергии системы. Мерой прочности служит энергия связи, которая определяется работой, нужной для разрушения данной связи.
Виды хим. связи: ковалентная (полярная, неполярная, обменная и донорно-акцепторная), ионная, водородная и металлическая.
Длина связи – расстояние между центрами атомов в молекуле. Энергия и длина связей зависят от характера распределения Эл. плотности между атомами. На распределение е плотности влияет пространственная направленность хим. связи. Если 2-х атомные молекулы всегда линейны, то формы многоатомных молекул м.б. различны.
Угол между воображаемыми линиями, которые можно провести через центры связанных атомов называется валентным. Распределение е плотности так же зависит от размеров ат. и их эо. В гомоатомных Эл. плотность распределена равномерно. В гетероатомных смещена в том направлении, которое способствует уменьшению энергии системы.
Между молекулами, валентно-насыщенными в обычном понимании, на расстояниях, превышающих размеры частиц, могут проявляться электростатические силы межмолекулярного притяжения, или так называемые силы Ван-дер-Ваальса. Как показывают квантово-механические расчеты, Епр. определяется суммой ориентационного, индукционного и дисперсионного взаимодействий: Епр=Еор+Еинд+Едисп. Ориентационное вз. проявляется между полярными молекулами, которые при приближении поворачиваются (ориентируются) друг к другу разноименными полюсами так, стобы пот Е сист. стала мин. Индукционное взаимодействие связано с процессами поляризации молекул окружающими диполями.
Дисперсионное взаимодействие возникает у любых молекул, независимо от их строения и полярности. Вследствие мгновенного несовпадения центров тяжести зарядов е облака и ядер образуется мгновенный диполь, который индуцирует мгновенные диполи в др.частицах.
Силы притяжения Ван-дер-Ваальса – дальнодействующие. На небольших расстояниях между молекулами заметными становятся близкодействующие силы отталкивания (силы Паули), которые возрастают при сближении частиц. Для неполярных молекул Е межмол. взаим опис.: 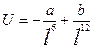 , где l-расст-е между мол., а и b – пост., завис от прир вещ-в. U0 – Е взаим. молек. на равновесном расстоянии… <=1…5кДж/моль, т.е. по сравнению с ковалентной связью межмолек. взаим. оч слабое.
, где l-расст-е между мол., а и b – пост., завис от прир вещ-в. U0 – Е взаим. молек. на равновесном расстоянии… <=1…5кДж/моль, т.е. по сравнению с ковалентной связью межмолек. взаим. оч слабое.
Промежуточный характер между валентным и межмолекулярным взаимодействием имеет водородная связь. Она хар-на для жидкостей, в состав молекул которых (вода, спирты, кислоты) входит положительно поляризованный атом водорода. Малые размеры и отсутствие внутренних е позволяют атому Н вступать в доп. взаим. с ков-но с ним не связ. отриц-но поляризованным атомом др. молекулы. Такая специф. связь имеет черты электростатич. и дон-акц. взаим. и прив. к обр. ассоциатов молекул.
Е водородных связей невелика (8…80 кДж/моль), и в области выс. т-р эти связи практически не существуют.
Ковалентная связь – связь, осуществляемая за счет образования е пар, принадлежащих обоим атомам. Различают полярную и неполярную. В случае полярной: в чистом виде может возникать только между одинаковыми атомами за счет объединения е с различными спинами в е пары. Ковалентная полярная связь возникает между атомами разных элементов, обладающих различной е-отрицательностью. При этом МО искажаются, т.к. е смещаются к более е-отр. Э (и при сохраняющейся е нейтральности молекулы, в ней появляются центры положительных и отрицательных зарядов, молекула становится диполем).. Способ образования ковалентной связи, когда каждый атом отдает по 1 е для образования общей е пары называется обменным.
Донорно-акцепторный тип ковалентной связи – Один атом предоставляет пару е, другой – свободную орбиталь.(нередко превышает число неспаренных е в его атомах…). Донорно-акцепторный механизм образования связи отличается от обменного только происхождением общей е пары, во всем остальном оба эти механизма тождественны. Часто один и тот же атом может выступать как в роли донора, таки в роли акцептора е. Механизм образования связи между такими атомами называют дативным.
МВС базируется на: каждая пара ат. в молекуле удерживается вместе при помощи одной или нескольких общих е пар; одинарная ков. связь 2-мя электронами с антипараллельными спинами, расп. на валентных орбиталях связывающихся атомов; при образовании связи происходит перекрывание волновых функций электронов, ведущее к увеличению е плотности между ат. и уменьшению общей Е системы; связь образуется в том направлении, при котором возможно максимальное перекрывание волновых функций; угол между связями в молекуле соответствует углу между образующими связь электронными облаками; из 2х орбиталей атома более прочную связь образует та, которая сильнее перекрывается орбиталью др. атома.
Геометрическая форма молекул зависит от направленности хим. связи. Атомы, у которых валентные е расположены на s АО, способны образовывать одинаково прочные связи в любых направлениях. Общее е облако в таких случаях сосредоточено вдоль линии связи (s-связь). Для p-АО макс. перекрещивание возможно и по линии связи ядер, и по обе стороны от нее(p-связь). Для d-орбиталей возможно s, p, δ-связь.
Гибридизация валентных орбиталей: при образовании хим. связей исходные атомные орбитали смешиваются, взаимно изменяются, образуя равноценные гибридные орбитали, которые отличаются от АО значительным увеличением электронной плотности в определенном направлении пространства.
sp-ГО являются диагональными О, т.е. угол между ними = 180. sp2-ГО (тригональные) расположены под углом 120. При sp3 гибридизации образуется 4 тетрагональные ГО, направленные к вершинам тетраэдра. 109,28’.(109,5)
sp-прямая линия, sp2, dp2, sd2 – треугольник, pd2-тригональная пирамида, sp3-тетраэдр, dsp2-квадрат, sp3dz*2 – тригональная бипирамида, sp3dx*2-y*2 – квадратная пирамида, sp3d2-октаэдр.
Образование комплексных соединений: донорно-акцепторный механизм взаимодействия комплексообразователя и лигандов. Комплексообразователь выступает в роли акцептора, а лиганд – в роли донора е. Геом. форма комплексных частиц определяется типом гибридизации АО комплексообразователя. Прием *ГВО* основан на принципе максимального перекрывания е облаков и содержит условия устойчивой гибридизации орбиталей: в гибридизации участвуют орбитали с близкими значениями энергии, т.е. s- и p-АО внешнего и d-АО внешнего и предвнешнего ЭУ и с дост. выс. е плотн. ГО должны быть ориент. и выт. в пр-ве так, чтобы Е их отталк. была миним., а перекр. с орб. соседн. ат. наиб. полно. Учитывается, что ГО вследств. их асимметрии в образовании p-связей участвовать не могут.
Теория отталкивания е пар валентных орбиталей: конфигурация связей многовал. ат. обуславливается числом связывающих и несвязывающих е пар в валентной оболочке центрального атома; ориентация облаков е пар вал. орб. опред. макс. взаимн. отталкиванием заполняющих их е. Теория ОЭПВО построена на след. допущ.: 1) неразличимости е, 2) действия кулоновских Сид, 3)действия сил отталквивания Паули.
Метод МО: молек. рассматривается как единое целое, кажд. е принадлежит молекуле в целом и движется в поле всех ее ядер и электронов; состояние i-го электрона описывается одноэл-й волновой функцией 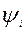 , характеризуемой определенным набором квантовых чисел; квадрат модуля волновой функции определяет плотность е облака; полное описание состояния е хар-ет молекулярная спин-орбиталь, выражаемая произведением МО и спиновой функции ψS; каждой МО соотв. опред. энергия, кот. слагается из кин. Е е, пот Е притяжения е ко всем ядрам и усредненной пот Е отталкивания данного е от всех остальных е; совокупность МО, называемая Эл. конфигурацией молекулы, строится на основе фундаментальных положений квантовой механики: принципа наим. Е, принципа Паули и правила Хунда; движение е взаимно независимое, и общая волновая функция основного состояния молекулы задается как произведение одноэлектронных волновых функций
, характеризуемой определенным набором квантовых чисел; квадрат модуля волновой функции определяет плотность е облака; полное описание состояния е хар-ет молекулярная спин-орбиталь, выражаемая произведением МО и спиновой функции ψS; каждой МО соотв. опред. энергия, кот. слагается из кин. Е е, пот Е притяжения е ко всем ядрам и усредненной пот Е отталкивания данного е от всех остальных е; совокупность МО, называемая Эл. конфигурацией молекулы, строится на основе фундаментальных положений квантовой механики: принципа наим. Е, принципа Паули и правила Хунда; движение е взаимно независимое, и общая волновая функция основного состояния молекулы задается как произведение одноэлектронных волновых функций  ; образование МО упрощенно рассматривается как лин.комб. АО.
; образование МО упрощенно рассматривается как лин.комб. АО.
При сложении волновых функций 2х валентных АО разных атомов, имеющих близкие значения Е, е плотность между ядрами ат. увеличивается, это ведет к обр. связывающей МО, имеющей более низкое значение Е, чем исходные АО.(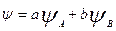 ).
).
При вычитании волновых функций 2х валентных АО разных атомов, имеющих близкие значения Е, е плотность между ядрами уменьшается, что ведет к образованию разрыхляющей МО, имеющей более высокое значение Е, чем исходные АО.
ЛК невалентных АО, как показывают квантовомех. расчеты, приводит к образованию МО, имеющих вид и Е, близкую к виду и Е исходн. АО, поэтому такие орбитали условно называют несвязывающими. Для возникновения МО требуются опред. условия: Е АО должны быть соизмеримы; е облака взаимодейств. атомов должны макс. перекрываться, чем значительнее перекрывание, тем прочнее связь; макс. перекрывание возможно для АО, обладающих одинаковыми свойствами симметрии относительно оси молекулы.
Образование МО возможно при ЛК: 2 s-АО (ss СМО, s*s РМО), 2 pz-АО (spz,s*pz), 2 px АО(ppx, p*px), аналогично с py. Разрешенные комбинации: s – s,pz,dz*2; pz-ан-но; px-px,dxz(py ан-но); dxz – px,dxz (dyx, dxy – ан-но); dz*2 – s, pz, dz*2, dx2-y2 – dx2-y2.
От H2 до N2 s2pz после p2px=2py, а от О2 до Ne2 наоборот…
Порядок связи: 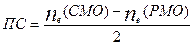 - показатель прочности молекулы. Если ПС = 0, значит энергия связи в молекуле равна нулю.
- показатель прочности молекулы. Если ПС = 0, значит энергия связи в молекуле равна нулю.
Магнитные свойства молекул: характер распределения е по МО может объяснить магн. св-ва частиц. Молекулы, суммарный спин которых = 0 проявляют диамагнитные свойства (во внешнем магнитном поле их собственные магнитные моменты ориентируются против магнитного поля), суммарный спин которых не равен 0 проявляют парамагнитные св-ва (наоборот).
Для кристаллического состояния характерно строго определенное расположение частиц во всем объеме – дальний порядок. (свойства – постоянная Т плавления, анизотропность) Это обуславливает анизотропию, или векторность свойств, кристаллов – различие физических свойств, таких как теплопроводность, сжимаемость, прочность на разрыв, коэффициент преломления света – в разных направлениях. Располагаясь в кристалле определенным образом, частицы образуют крист. решетку – трехмерное упорядоченное геометрическое распределение в пр-ве точек, называемых узлами.
Элементарная ячейка – это мысленно выделенная часть кристаллической решетки, включающая все элементы симметрии данного кристалла, праллельная трансляция которой по всем направлениям дает тело кристалла.
(n-число частиц, требуемое для построения куба, K –координационное число (число одинаковых частиц, расположенных на кратчайшем расстоянии от данной частицы (число ближайших соседей))) Кубическая система: элементарный куб (тип NaCl), n=1, K=6, но т.к. в узлах элем. ячейки находятся ионы Na и Cl n=1/2NaCl, т.е. требуется половина молекулы для построения ячейки. Объемоцентрированный куб – тип CsCl. K=8, n=1/8*8+1=2. Так же нужно учесть, что в узлах находятся ионы Cs и Cl.
В металлической связи: Гранецентрированная КР, К=8, кратчайшее расстояние между центрами атомов = половине диагонали куба, n=2(число ат, необх. для постр.), плотность упаковки ~68% K, Na, W…
Гранецентрированная кубическая решетка: K=12, расстяние=половине диагонали грани, n=4, плотность упаковки ~74%, Cu, Ni g-Fe, Pb…..
В соответствии с природой составляющих частиц крист. решетки м.б. ионными, атомными(ковалентными или металлическими) и молекулярными. Ионные КР построены из катионов и анионов, между кот. действуют электростатические силы притяжения. Ионы м.б. простыми, как, например в кристалле NaCl, или сложными, как в кристалле (NH4)2SO4. Строение таких кристаллов определяется соотношением радиусов ионов и принципом электронейтральности кристалла. Всл-е ненаправленного и ненасыщаемого хар-ра ионной связи, для ионных крист. хар-ны высокие Т плавления и большая твердость. Однако ИК отличаются повышенной хрупкостью, т.к. механическое воздействие приводит к нарушению правильного расположения разноименно заряженных ионов, что уменьшает Е их взаимодействия.
В узлах атомно-ковалентной КР находятся атомы одинак. или разл. Э, осуществляющие направленные или ковалентные связи, кол-во которых определяется валентными возможностями атомов.
В металлических КР атомы удерживаются металлической связью, которая определяет построение решетки по принципу плотной упаковки и такие хар-е св-ва металлов, как высокая тепло- и электропроводность. В узлах молекулярной КР расположены молекулы, связанные между собой слабыми межмолекулярными силами. Если основной вклад в межмол. взаим. внос. силы Ван-дер-Ваальса, крист. хар-ся высокими значениями корд. чисел (для I2, напр. К=12). Если между мол. действ. направленные водородные связи, К меньше и зависит от е строения отриц-но поляризованного атома. У льда каждая молекула тетраэдрически связана с соседними, и К=4, соответственно. Т.к. Е межмол. взаим. невелика, для в-в с молекулярной КР хар-ны низкие ТП, летучесть, невысокая твердость.
Термодинамическая система - часть пространства, выделенная для рассмотрения и отделенная от окружающей среды реальной или условной границей. Обмен с окружающей средой - открытая система; нет обмена - закрытая. Равновесное состояние - при к-ом ее св-ва неизменны во времени и в ней отсутствуют потоки в-ва или энергии.
Количество теплоты Q, сообщенное системе, расходуется на увеличение ее внутренней энергии DU и на совершение работы А системой, т.е. Q=DU+A. Для элем. проц. с б.м. изменением параметров: δQ=dU+δA=dU+pdV+δA’, где δA’ – сумма др. видов работ (электр., сил пов-го натяж.). В термомеханических системах δA’=0.
Для идеального газа: T=const:  . V=const Q=DU. P=const:
. V=const Q=DU. P=const:  ,
,  , H=U+pV – жнтальпия, по физ. смыслу энтальпия – энергия расширения системы.
, H=U+pV – жнтальпия, по физ. смыслу энтальпия – энергия расширения системы.
Тепловым эффектом хим. реакции называют кол-во теплоты, выделяемое или поглощаемое в результате осуществления хим. процесса в термомеханической системе (δA’=0) при постоянном давлении или объеме и равенстве температур исходных веществ и продуктов. Раздел химической термодинамики, изучающий тепловые эффекты реакций и фазовых превращений, называют термохимией.
Различают ТЭ при const V и P.  ,
, 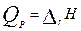 . Тепловые эффекты
. Тепловые эффекты 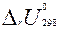 и
и 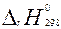 , приведенные к стандартным термод. условиям (p=101325Па=1атм=760мм рт. ст., Т=298,15 К), называют стандартной внутренней энергией и стандартной энтальпией соответственно.
, приведенные к стандартным термод. условиям (p=101325Па=1атм=760мм рт. ст., Т=298,15 К), называют стандартной внутренней энергией и стандартной энтальпией соответственно.
Стандартные тепловые эффекты при постоянном давлении и постоянном объеме связаны уравнением:  , T=298 K.
, T=298 K.
Стандартной энтальпией образования вещества (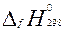 ) называют тепловой эффект реакции образования 1 моль данного вещества из соответствующего кол-ва простых веществ, находящихся в стандартных условиях. Стандартная энтальпия м.б. отрицательной (получаемое в-во более термод. стабильно), =0 (для простых в-в в стандартных состояниях), больше нуля. При горении в-в всегда выделяется тепло, поэтому станд. энт. сгорания всегда отрицательна для в-в, способных окисляться в кислороде, или равна 0 для негорючих соед.
) называют тепловой эффект реакции образования 1 моль данного вещества из соответствующего кол-ва простых веществ, находящихся в стандартных условиях. Стандартная энтальпия м.б. отрицательной (получаемое в-во более термод. стабильно), =0 (для простых в-в в стандартных состояниях), больше нуля. При горении в-в всегда выделяется тепло, поэтому станд. энт. сгорания всегда отрицательна для в-в, способных окисляться в кислороде, или равна 0 для негорючих соед.
Закон Гесса: Тепловой эффект хим. реакции определяется только видом и состоянием исходных веществ и продуктов, но не зависит от пути процесса.
1-е следствие: тепловой эффект реакции = сумме энтальпий образования продуктов за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. 2-е следствие: Тепловой эффект реакции = сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов с учетом стехиом. коэф.
Второй закон термодинамики. Энтропия и ее свойства. Энтропия и термодинамическая вероятность (уравнение Больцмана).Третий закон термодинамики. Абсолютная энтропия вещества. Расчет изменения энтропий в процессе хим. Реакции. Зависимость энтропии от температиуры.
Постулат Клаузиуса: теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. В применении к элементарному обратимому процессу:  , где числитель – алгебраическая сумма теплоты, полученной и отданной рабочим телом (идеальным газом) при совершении процесса, Дж, Т – абсолютная т-ра.
, где числитель – алгебраическая сумма теплоты, полученной и отданной рабочим телом (идеальным газом) при совершении процесса, Дж, Т – абсолютная т-ра.  - приведенная теплота. Энтропия есть функция состояния, изменение которой = алгебраической сумме приведенной теплоты всех элементов обратимого процесса. Т.к. А, совершаемая сист. в необр проц. < раб., сов. в обр проц:
- приведенная теплота. Энтропия есть функция состояния, изменение которой = алгебраической сумме приведенной теплоты всех элементов обратимого процесса. Т.к. А, совершаемая сист. в необр проц. < раб., сов. в обр проц:  . В изолированной системе знак изменения энтропии является критерием направленности самопроизвольного процесса: если DS=0, т.е. S достигла своего макс. значения, то система находится в состоянии термод. равновесия. Если DS>0, то процесс самопроизвольно протекает в прямом направлении, если DS<0, то самопр. протекать может лишь обратный процесс.
. В изолированной системе знак изменения энтропии является критерием направленности самопроизвольного процесса: если DS=0, т.е. S достигла своего макс. значения, то система находится в состоянии термод. равновесия. Если DS>0, то процесс самопроизвольно протекает в прямом направлении, если DS<0, то самопр. протекать может лишь обратный процесс.
Термодинамической вероятностью w называют число микросостояний, через которое можно реализовать данное макросостояние системы.
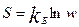 , где kб- константа Больцмана. По Больцману: энтропия – функция термодинамической вероятности того или иного состояния индивидуального вещества или системы. Согласно этому Ур-ю, второе начало термод. можно сформулировать так:
, где kб- константа Больцмана. По Больцману: энтропия – функция термодинамической вероятности того или иного состояния индивидуального вещества или системы. Согласно этому Ур-ю, второе начало термод. можно сформулировать так:
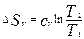 ,
, 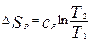 . Эти Ур-ия можно рассматривать в процессах изохорного и изобарного нагрева и охл. конденсированных веществ.
. Эти Ур-ия можно рассматривать в процессах изохорного и изобарного нагрева и охл. конденсированных веществ. 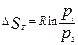 .
.

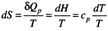

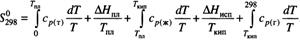
|
|
Дата добавления: 2015-04-24; Просмотров: 659; Нарушение авторских прав?; Мы поможем в написании вашей работы!