
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 9. Окислительно-восстановительные процессы в химии 2 страница
|
|
|
|
| в) Zn(OH)2 |
9-127. Первичный продукт коррозии луженого железа [ 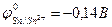 ,
, 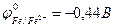 ] во влажном воздухе имеют состав
] во влажном воздухе имеют состав
| г) Fe(OH)2 |
9-128. Протекторная защита корпуса стальной цистерны (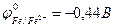 ) может быть осуществлена с помощью
) может быть осуществлена с помощью
в) марганца ( ) )
| |
б) цинка ( ) )
|
9-129. Протекторная защита корпуса стальной цистерны (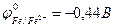 ) НЕ может быть осуществлена с помощью
) НЕ может быть осуществлена с помощью
а) свинца ( ) )
| |
г) никеля (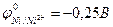 ) )
|
9-130. Протекторная защита корпуса стальной цистерны (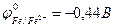 ) может быть осуществлена с помощью
) может быть осуществлена с помощью
а) алюминий ( ) )
| |
б) цинка ( ) )
|
9-131. Продуктами коррозии оцинкованного железа при повреждении покрытия в кислой среде (раствор HCl) будут( ,
, 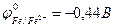 )
)
| в) ZnCl2 и H2 |
9-132. Продуктами коррозии луженого железа при повреждении покрытия в кислой среде (раствор HCl) будут
| г) FeCl2 и H2 |
9-133. Вблизи от места соединения медной заклепкой листов стали будут образовываться при коррозии в кислой среде (раствор HCl)
| г) FeCl2 и H2 |
9-134. Блуждающие токи будут
а) усиливать коррозионное поражение
9-135. Электролизом называется окислительно-восстановительная реакция,
в) протекающая на электродах при пропускании электрического тока
9-136. Катод при электролизе
| б) заряжен отрицательно |
9-137. Анод при электролизе
| а) заряжен положительно |
9-138. Процесс... протекает на катоде при электролизе.
| а) восстановления |
9-139. Процесс... протекает на аноде при электролизе.
| б) окисления |
9-140. Масса вещества, выделяющегося на электроде при электролизе, находится по формуле:
а) 
|
9-141. Наиболее вероятный процесс на катоде при электролизе
г) восстановление частиц с наибольшим потенциалом
|
|
|
9-142. Наиболее вероятный процесс на аноде при электролизе
г) окисление частиц с наименьшим потенциалом
9-143. Молекулы воды восстанавливаются на катоде при электролизе водных растворов, если
в) 
| |
9-144. Ионы металла восстанавливаются на катоде при электролизе водных растворов, если
г) 
|
9-145. Инертный анод при электролизе
| б) платиновый |
9-146. Инертный анод при электролизе
| а) графитовый | |
9-147. Активный анод при электролизе
| в) серебряный | |
9-148. Процесс окисления... протекает на графитовом аноде при электролизе водных растворов кислородсодержащих солей
| г) молекул воды |
9-149. Процесс окисления... протекает на графитовом аноде при электролизе водных растворов бескислородных солей
| б) бескислородных анионов |
9-150. Последовательность восстановления катионов металла на катоде:
а) Au+ ( ) )
| в) Cu2+ ( ) )
|
б) Hg2+ ( ) )
| г) Zn2+ ( ) )
|
9-151. Процесс... протекает на медном аноде при электролизе раствора CuCl2
| а) Cu2++2e– = Cu0 |
9-152. Восстанавливаться на катоде при электролиз растворов будут ионы
| а) Cu2+ |
9-153. Процесс... будет происходить на катоде при электролизе водного раствора Na2SO4 (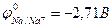 )
)
| б) 2H2O + 2e– = H20 + 2OH– |
9-154. Последовательность восстановления катионов металла на катоде
а) Ag+ (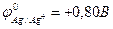 ) )
| в) Pb2+ (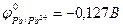 ) )
|
б) Cu2+ ( ) )
| г) Ni2+ (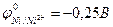 ) )
|
абвг
9-155. Процесс... протекает на катоде при электролизе раствора NiCl2 (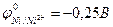 ).
).
| г) Ni2+ + 2e– = Ni0 и 2H2O + 2e– = H20 + 2OH– |
9-156. Процесс... будет протекать на катоде при электролизе раствора ZnSO4 ( ).
).
| г) Zn2+ + 2e– = Zn0 и 2H2O + 2e– = H20 + 2OH– |
9-157. Кислород выделяется на аноде при... воды
| а) окислении |
9-158. Продуктами электролиза водного раствора хлорида цинка ( ) с инертными электродами будут
) с инертными электродами будут
| в) цинк, хлор, водород и гидроксид цинка | |
9-159. Ионы OH– образуются у электрода при электролизе водного раствора соли. Этот электрод называется –.катод..
|
|
|
9-160. Продуктами электролиза с графитовыми электродами водного раствора сульфата меди ( ) будут
) будут
| г) медь, кислород и серная кислота | |
9-161. Ионы Н+ образуются у электрода при электролизе водного раствора соли. Этот электрод –анод...
9-162. Практическая и теоретическая массы вещества, выделившегося на катоде, составляют 48 и 80 г соответственно. Выход по току (в %) равен.60..
10-1. Соединения, построенные из большого числа повторяющихся звеньев, называются б) полимерами
10-2. Соединения, построенные из не очень большого числа повторяющихся звеньев, называются в) олигомерами
10-3. Соединения, из которых получают полимеры, называются а) мономерами
10-4. Индекс «n» в реакции nCH2=CH2"(–CH2–CH2–)n называется б) степенью полимеризации
10-5. Полимеры используются для получения а) волокон б) лаков в) клеев д) пластмассы
10-6. Степень полимеризации n = 2-10 в в) олигомерах
10-7. Белки – это полимеры б) органические природные
10-8. Пластмассы при эксплуатации находятся в состоянии в) стеклообразном
10-9. Реакция соединения молекул мономера в полимерную цепь без образования побочных продуктов называется б) полимеризацией
10-10. Реакция соединения молекул мономера в полимерную цепь с образованием побочных низкомолекулярных веществ называется б) полимеризацией
10-11. Полимеризация может быть вызвана а) нагреванием б) облучением в) действием свободных радикалов д) катализаторами
10-12. Получение полимеров может осуществляться через образование ионов при ионной полимеризации в) катионной г) анионной
10-13. Сахароза C12H10O11 – это б) олигомер
10-14. Резина – это полимер, имеющий строение в) пространственное
10-15. Полимер формулой (–CH2–CH2–)n называется б) полиэтиленом
10-16. Схема реакции
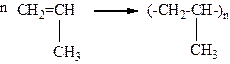 отображает получение
отображает получение
а) полипропилена
10-17. Соответствие между словами и цифрами
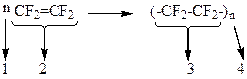
| коэффициент | а) |
| мономер | б) |
| структурное звено | в) |
| степень полимеризации | г) |
10-18. Соответствие между словами и цифрами

| 1) | вязкотекучее состояние | а) | |
| 2) | стеклообразное состояние | б) | |
| 3) | эластическое состояние | в) |
10-19. Соответствие между формулой и названием полимера
|
|
|
| 1) | 
| а) | Полипропилен |
| 2) | 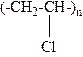
| б) | Полихлорвинил |
| 3) | 
| в) | Полистирол |
| 4) | 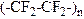
| г) | Полифторэтилен |
10-20. Последовательность стадий реакции полимеризации
| а) Инициирование цепи | в) Передача цепи |
| б) Рост цепи | г) Обрыв цепи |
10-21. Соответствие между словами и рисунками
| 1) | линейная структура полимера | а) | 
|
| 2) | трехмерная структура полимера | б) | 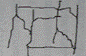
|
| 3) | разветвленная структура полимера | в) | 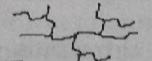
|
| 4) | лестничная структура полимера | г) | 
|
10-22. Амфорные полимеры по физическому состоянию делятся на группы
а) стеклообразные б) эластические
10-23. Мономерами для получения бутадиенстирольного каучука являются а) бутадиен б) стирол в) бутастирол
10-25. Полимеры по отношению к нагреванию делятся на: а) термопластичные б) термореактивные
10-26. Механическая прочность полимеров возрастает с увеличением их молекулярной массы.
10-27. Молекулярные массы полимера и мономера равны 30000 и 100 соответственно. Определить степень полимеризации n.= 300
11-1. Определение элементов в соединениях или соединений в смесях – это задача б) качественного анализа
11-2. Определение относительных количеств элементов в соединениях и соединений в смесях – это задача а) количественного анализа г) объёмного анализа
11-3. Водородный показатель pH раствора рассчитывается по формуле а) pH = –lgCH+
11-4. Химическая идентификация и анализ веществ являются предметом а) аналитической
11-5. Гравиметрический или весовой анализ – это один из методов а) физико-химического анализа
11-6. Момент, когда количество добавляемого вещества эквивалентно количеству определяемого вещества называется а) точкой эквивалентности
11-7. Интенсивность электромагнитного излучения пробы отражает б) количество анализируемого вещества
11-8. Атомная спектроскопия относится к в) физическим методам анализа
11-9. Сравнение интенсивной окраски исследуемого раствора с окраской стандартного раствора проводится при методе анализа б) колориметрическом
11-10. Метод, основанный на измерении величины электродных потенциалов, зависящих от концентрации раствора, называется …. методом анализа б) потенциометрическим
|
|
|
11-11. Соответствие между методами анализа и основными характеристиками вещества
| 1) | гравиметрический | а) | осадок определённой массы |
| 2) | объемный газовый анализ | б) | количество газа |
| 3) | кондуктометрия | в) | измерение электропроводности раствора |
| 4) | потенциометрия | г) | измерение ЭДС элементов |
11-12. Последовательность любого анализа а) отбор пробы в) сравнение с этанолом
11-13. Согласно закону Ламберта-Беера: интенсивность поглощённого раствором света пропорциональна а) концентрации вещества
11-14. Соответствие основных методов количественного анализа и измеряемой величиной следующее
| 1) | гравиметрический метод | а) | масса вещества |
| 2) | кулонометрия | б) | количество электричества |
| 3) | вискозиметрический метод | в) | вязкость |
| 4) | криоскопия | г) | понижение температуры замерзания |
11-15. Окислитель – это частица, которая...электроны а) принимает
11-16. Разделение веществ, обладающих различной адсорбционной способностью, проводят с помощью метода анализа, называемого а) хроматографией
11-17. Методы анализа, основанные на изучении спектров излучения, называются...методами а) спектральными
11-18. Формулой 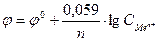 описывается зависимость электродного потенциала φ от... С
описывается зависимость электродного потенциала φ от... С
а) концентрации
11-19. 10 мл раствора щелочи концентрацией 1 моль/л нейтрализовали 5 мл кислоты. Концентрация кислоты _2__ моль/л.
11-20. Предел обнаружения вещества при предельной концентрации 10–7 моль/л и объеме раствора 20 мл равен..2. мкг
11-21. Электродный потенциал медного электрода в растворе с концентрацией 1 моль/л равен..0,34. вольт. ( ).
).
12-1. Металлами являются а) Na г) Fe е) Zn
12-2. Металлами являются а) Ca в) Cu г) Cr
12-3. Число электронов на внешнем слое атомов металлов НЕ может быть в) 5 д) 6
12-4. Металлами являются все г) f-элементы
12-5. Внешний электронный слой металлов 4-го периода заполняют а) s-электроны
12-6. Металлы образованы связью б) металлической
12-7. Строение металлов а) кристаллическое
12-8. Металлическая связь в компактных металлах возникает между г) катионами металла и свободными электронами
12-9. Электропроводность металлов объясняется наличием в) свободных электронов в зоне проводимости
12-10. Теплопроводность металлов объясняется наличием б) свободных электронов в зоне проводимости
12-11. Металлы при стандартных условиях могут быть а) жидкими
12-12. Металлы в химических реакциях проявляют свойства а) восстановителя
12-13. Металлы имеют общие физические свойства а) электропроводность б) теплопроводность г) пластичность д) ковкость
12-14. Самый тугоплавкий металл в) вольфрам
12-15. d-элементы – это элементы, у которых происходит заполнение электронами в) d-подуровней
12-16. Самый легкоплавкий металл г) ртуть
12-17. Металлическая кристаллическая решетка состоит из в) положительных ионов, находящихся в узлах решетки, и свободных электронов
12-18. Электропроводность и теплопроводность металлов связаны с наличием в кристаллической решетке б) свободных электронов
12-19. Парамагнитные свойства металлов определяются наличием б) неспаренных электронов
12-20. Электроны внешнего слоя у d -элементов располагаются на а) s-подуровнях
12-21. Катионы d-элементов при образовании связей в комплексных соединениях выступают преимущественно в качестве
| а) доноров | |
12-22. Зона проводимости металлов
г) перекрывается с валентной зоной
12-23. Дефектами кристаллического строения металлов являются
| а) дислокации | б) вакансии |
12-24. Щелочные металлы – это
| в) K | д) Li |
12-25. Последовательность заполнения подуровней
| а) 2s | б) 2p | в) 3s | г) 3p | д) 4s | е) 3d |
12-26. Железо (порядковый номер 26) имеет электронную формулу:
| а) 1s22s22p63s23p64s23d6 |
12-27. Цинк (порядковый номер 30) имеет электронную формулу:
| а) 1s12s22p63s23p63d104s2 |
12-28. Магний (порядковый номер 12) имеет электронную формулу
| б) 1s22s22p63s2 |
12-29. Явление, при котором одно вещество может иметь в зависимости от условий различные кристаллические структуры, называется
| в) полиморфизм |
12-30. Металлам соответствуют электронные структуры
| б) 1s22s22p63s2 | д) 1s22s22p63s23p1 |
| в) 1s22s22p63s24p6 4s23d6 |
12-31. Металлические свойства калия больше, чем натрия, так как радиус атома калия больше…
12-32. s-Элементы (металлы) в химических реакциях
| а) восстановители |
12-33. Восстановительные свойства s-элементов
а) усиливаются по группе сверху вниз
12-34. Щелочные и щелочноземельные металлы реагируют
| а) с водой | |
| б) с кислотами |
12-35. Натрий реагирует с
| а) кислородом воздуха | г) водой |
| б) чистым кислородом |
12-36. Натрий при взаимодействии с кислородом образует
| б) пероксид натрия Na2O2 |
12-37. Натрий взаимодействует с водой в соответствии с уравнением:
| в) 2Na + 2H2O " 2NaOH + H2# |
12-38. Гидроксид натрия NaOH применяется
в машиностроении
| а) для обезжиривания деталей | |
| б) для нейтрализации стоков |
12-39. Алюминий в природе находится
| в) в свободном виде и в составе соединений | |
| б) в составе соединений |
12-40. Электронная формула алюминия (порядковый номер 13)
| в) 1s22s22p63s23p1 | |
12-41. Алюминий вступает в химические реакции
| а) 2Al + 6HCl " 2AlCl3 + 3H2# | в) 2Al + 3Cl2 " 2AlCl3 |
12-42. Оксид алюминия Al2O3 в химических реакциях проявляется свойства
| а) окислителя | |
| б)амфотерные |
12-43. «Проскок» электрона происходит у атомов d-элементов:
| а) хрома (номер 24) | в) меди (номер 29) |
12-44. Сплавы железа
| а) чугун | д) сталь |
12-45. Железо в соединениях может проявлять степени окисления
| б) +2 |
12-46. Железо растворяется в растворе серной кислоты с образованием вещества
| в) FeSO4 |
12-47. Железо реагирует с раствором соляной кислоты с образованием соединения
| а) FeCl2 |
12-48. Железо реагирует с молекулярным хлором с образованием соединения
| б) FeCl3 |
12-49. Оксид железа (II) может проявлять свойства
| а) основные | д) окислительные | |
| г) восстановительные |
12-50. Оксид железа (II) может реагировать с
| а) кислотами | в) кислородом воздуха |
12-51. Оксид железа (III) может реагировать с:
| а) кислотами | |
| б) гидроксидом натрия NaOH |
12-52. Алюмотермический процесс получения железа
| а) Fe2O3 + 2Al " 2Fe + Al2O3 |
12-53. Практически НЕ осуществима реакция
| в) Fe + ZnSO4 " FeSO4 + Zn |
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 937; Нарушение авторских прав?; Мы поможем в написании вашей работы!