
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
739.
738.
737.
736.
735.
734.
730.
727.
725.
724.
723.
722.
721.
720.
719.
718.
717.
716.
| Дано: Cн(ZnSO4)=0.01н. Cн(AgNO3)=0.1н. T = 27oC =300 K ЭДС =?. | (-)Zn|ZnSO4||AgNO3|Ag(+)
(-) Zn – 2e- = Zn2+
(+) Ag1+ + 1e- = Ag Zn +2Ag1+ = Zn2+ + Ag
[Zn2+] = Cм(ZnSO4) = Сн/2 = 0.01/2 = 0.005 моль/л
[Ag+] = Cм(AgNO3) = Сн = 0.1 моль/л
ЭДС = E(Ag+/Ag) - E(Zn2+/Zn) = E0(Ag+/Ag) - E0(Zn2+/Zn) +  = -0.8 – (-0.76) + = -0.8 – (-0.76) + 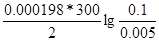 = 1.58B = 1.58B
|
| Дано: Cн(Mg(NO3)2)=0.2н. Cн(SnSO4) = 0.03н. T = 17oC = 290 K ЭДС =?. | (-)Mg|Mg(NO3)2||SnSO4|Sn(+)
(-) Mg – 2e- = Mg2+
(+) Sn2+ + 2e- = Sn Mg + Sn2+ = Mg2+ + Sn
[Mg2+] = Cм(Mg(NO3)2) = Сн/2 = 0.2/2 = 0.1 моль/л
[Sn2+] = Cм(SnSO4) = Сн/2 = 0.03/2 = 0.015 моль/л
ЭДС = E(Sn2+/Sn) - E(Mg2+/Mg) = E0(Sn2+/Sn) - E0(Mg2+/Mg) +  = -0.14 + 2.37 + = -0.14 + 2.37 +  = 2.21 В. = 2.21 В.
|
| Дано: Cн(Fe(NO3)2)=0.03н. Cн(Pb(NO3)2)=0.1н. T = 37oC = 310 K ЭДС =?. | (-)Fe|Fe(NO3)2|| Pb(NO3)2|Pb(+)
(-) Fe – 2e- = Fe2+
(+) Pb2+ + 2e- = Pb Fe + Pb2+ = Fe2+ + Pb
[Fe2+] = Cм(Fe(NO3)2) = Сн/2 = 0.03/2 = 0.015 моль/л
[Pb2+] = Cм(Pb(NO3)2) = Сн/2 = 0.1/2 = 0.05 моль/л
ЭДС = E(Pb2+/Pb) - E(Fe2+/Fe) = E0(Pb2+/Pb) - E0(Fe2+/Fe) +  = -0.13 + 0.45 + = -0.13 + 0.45 +  = 0.34 В. = 0.34 В.
|
| Дано: Cн(MnCl2)=0.01н. Cн(CdCl2)= 0.5н. T = 25oC = 298 K ЭДС =?. | (-)Mn|MnCl2||CdCl2|Cd(+)
(-) Mn – 2e- = Mn2+
(+) Cd2+ + 2e- = Cd Mn+ Cd2+=Mn2+ +Sn
[Mn+] = Cм(MnCl2) = Cн/2 = 0.01/2 = 0.005 моль/л
[Cd2+] = Cм(CdСl2) = Сн/2 = 0.05/2 = 0.025 моль/л
ЭДС = E(Cd2+/Cd) - E(Mn2+/Mn) = E0(Cd2+/Cd) - E0(Mn2+/Mn) +  = -0.40 + 1.17 + = -0.40 + 1.17 +  = 0.749 В. = 0.749 В.
|
| Дано: Cн(NiCl2) = 0.04н. Cн(CuCl2)= 0.08н. T = 65oC = 338 K ЭДС =?. | (-)Ni|NiCl2||CuCl2|Cu(+)
(-) Ni – 2e- = Ni2+
(+) Cu2+ + 2e- = Cu Ni + Cu2+ = Ni2+ + Cu
[Ni2+] = Cм(NiCl2) = Сн/2 = 0.04/2 = 0.02 моль/л
[Сu2+] = Cм(CuCl2) = Сн /2= 0.08/2 = 0.04 моль/л
ЭДС = E(Cu2+/Cu) - E(Ni2+/Ni) = E0(Cu2+/Cu) - E0(Ni2+/Ni) +  = 0.34 + 0.25 + = 0.34 + 0.25 +  = 0.6 В. = 0.6 В.
|
| Дано: Cн(Cd(NO3)2)=0.06н. Cн(AgNO3) = 0.05н. T = 57oC = 330 K ЭДС =?. | (-)Cd|Cd(NO3)2||AgNO3|Ag(+)
(-) Cd – 2e- = Cd2+
(+) Ag+ + e- = Ag
Cd + 2Ag+ = Cd2+ + 2Ag Cd + 2AgNO3 = Cd(NO3)2 + 2Ag
[Cd2+] = Cм(Cd(NO3)2) = Сн/2 = 0.06/2 = 0.03 моль/л
[Ag+] = Cм(AgNO3) = Сн = 0.05 моль/л
ЭДС = E(Ag+/Ag) - E(Cd2+/Cd) = E0(Ag+/Ag) - E0(Cd2+/Cd) +  - - 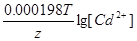 = 0.8 + 0.4 + = 0.8 + 0.4 +  - -  = 1.15 В = 1.15 В
|
| Дано: Cн(Sn(NO3)2)=0.07н. Cн(Hg(NO3)2)=0.09н. T = 23oC = 290 K ЭДС =?. | (-)Sn|Sn(NO3)2||Hg(NO3)2|Hg(+)
(-) Sn – 2e- = Sn2+
(+) Hg2+ + 2e- = Hg
Sn + Hg2+ = Sn2+ + Hg Sn + 2Hg(NO3)2 = Sn(NO3)2 + Hg
[Sn2+]= Cм(Sn(NO3)2) = Сн/2 = 0.07/2 = 0.035 моль/л
[Hg2+]= Cм(Hg(NO3)2) = Сн/2 = 0.09/2 = 0.045 моль/л
ЭДС = E(Hg2+/Hg) - E(Sn2+/Sn) = E0(Hg2+/Hg) - E0(Sn2+/Sn) +  = 0.79 + 0.14 + = 0.79 + 0.14 + 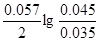 = 0.94 В = 0.94 В
|
| Дано: Cн(Al2(SO4)3)=0.3н. Cн(Bi(NO3)3)=0.3н. T = 33oC = 310 K ЭДС =?. | (-)Al|Al2(SO4)3||Bi(NO3)3|Bi(+)
(-) Al – 3e- = Al3+
(+) Bi3+ + 3e- = Bi
Al + Bi3+ = Al3+ + Bi
[Al3+]= Cм(Al2(SO4)3) = Сн/3 = 0.3/3 = 0.1 моль/л
[Bi3+]= Cм(Bi(NO3)3) = Сн/3 = 0.3/3 = 0.1 моль/л
ЭДС = E(Bi3+/Bi) - E(Al3+/Al) = E0(Bi3+/Bi) - E0(Al3+/Al) +  = 0.2 + 1.62 + = 0.2 + 1.62 +  = 1.82 В = 1.82 В
|
| Дано: Cн(CaCl2) = 0.5 н. Cн(H2SO4)=0.02н. T = 20oC = 293 K ЭДС =?. | (-)Ca|CaCl2||H2SO4|H2(Pt)(+)
(-) Сa – 2e- = Ca2+
(+) 2H+ + 2e- = H2
Ca + 2H+ = Ca2+ + H2
[Ca2+] = Cн(CaCl2) = 0.5 н = 0.25 моль/л
[Н+] = 2Cн(H2SO4) = 0.04 н = 0.02 моль/л
ЭДС = E(H+/H2) - E(Ca2+/Ca) = E0(H+/H2) - E0(Ca2+/Ca) + 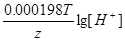 - - 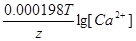 = 0 + 2.87 + = 0 + 2.87 + 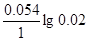 - - 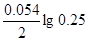 = 2.79 В. = 2.79 В.
|
| Дано: Cн(Li2SO4) = 0.1н Cн(AgNO3) = 0.1н T = 0oC = 273 K ЭДС =?. | (-)Li|Li2SO4||AgNO3|Ag(+)
(-) Li – 1e- = Li+
(+) Ag+ + 1e- = Ag Li + Ag+ = Li+ + Ag
[Li+] = 2Cм(Li2SO4) = Сн = 0.1 моль/л
[Ag+] = Cм(AgNO3) = Сн = 0.1 моль/л
ЭДС = E(Ag+/Ag) - E(Li+/Li) = E0(Ag+/Ag) - E0(Li+/Li) + 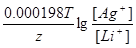 = 0.8 + 3.02 + = 0.8 + 3.02 +  = 3.82 В. = 3.82 В.
|
726. Гальванический элемент с максимальным значением ЭДС: (-)Li|Li2SO4||AuNO3|Au(+) ЭДС = Eo(Au+/Au) - Eo(Li+/Li) = 1.68+3.02 = 4.7 В
|
|
|
| А) Медь – анод. (-)Cu|CuSO4||Ag2SO4|Ag(+) E = E0(Ag+/Ag) - E0(Cu2+/Cu) = 0.8 – 0.34 = 0.46 В. |
| Б) Медь – катод. (-)Fe|FeSO4||СuSO4|Cu(+) E = E0(Cu2+/Cu) - E0(Fe2+/Fe) - = 0.34 + 0.45 = 0.79 В. |
728. KMnO4 + FeSO4 + H2SO4 = MnSO4 + Fe2(SO4)3 + K2SO4 + H2O.
| (-)Fe|Fe2+,Fe3+||MnO4-, Mn2+|Fe(+) |
729. K2Cr2O7 + K2SO3 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O.
| Cr2O72-,Cr3+:φ0 = 1.33 B, SO32-, SO42-: φ0 = 0.17 B |
| (-)Pt| SO32-, SO42-, H+|| Cr2O72-,Cr3+, H+ |Pt(+) |
| (-)Pt, H2| H+|| H+ | H2, Pt(+) |
| pH1 =4 pH2 = 2 |
pH = -lgC(H+), C1(H+) = 10-2 , C2(H+) = 10-4 . E0 (H2/H+) = 0 B.
E = 
731. Концентрационные элементы – гальванические элементы, образованные одинаковыми электродами, опущенными в растворы своих солей разной концентрации.
| (-)Cu| CuSO4(C1 = 0.1%)|| CuSO4(C2 = 5.0%) | Cu (+) |
| ЭДС = (0.059/z)*lg(C2/C1) = (0.059/2)lg(5/0.1) = 0.05 В. |
732. Топливный элемент – это гальванический элемент, в котором в качестве активного материала отрицательного электрода используются либо природное топливо (природный газ, содержащий углеводород), либо водород, окись углерода и др. восстановители. Активным материалом положительного материала служит кислород. Токообразующая реакция сводится к окислению топлива.
|
|
|
Водород-кислородный ТЭ разделен электродами на три плоскости – водородную, кислородную и промежуточную, заполненную электролитом. Электроды изготовлены из пористого никеля, электролитом является раствор КОН, водород и кислород подаются под давлением 30-75 атм. Элемент работает при Т=2000 С. Схема: (-)Н2| КОН, Н2О| O2(+)
Анод: 2Н2 – 4е- + 4ОН- = 4Н2О, катод: О2 + 4е- + 2Н2О = 4ОН-
Общая реакция: 2Н2 + О2 = 2Н2О.
733. Аккумуляторы – химические источники тока, которые могут быть использованы многократно. Их работоспособность восстанавливается многократно, т.к. в основе их действия лежат химически обратимые процессы. Свинцовый аккумулятор состоит из чередующихся пластин, одна из которых представляет собой PbO2, а вторая – металлический свинец в виде пористой губки. Пластины погружены в 35-40% раствор серной кислоты. Электрохимическая схема заряженного аккумулятора: (+)PbO2|H2SO4,H2O|Pb(-)
При работе (разрядке) протекают реакции: (+)Pb –2e - + SO42- = PbSO4 , (-)PbO2 +2e - + SO42- + 4H+ = PbSO4 + 2H2O.
Электрохимическая схема разряженного аккумулятора: (-)PbSO4|H2SO4,H2O|PbSO4(+)
Протекают процессы: (-)PbSO4+2e - = Pb- + SO42, (+)PbSO4 -2e - + 2H2O.= PbO2+ + SO42- + 4H+
| Дано: E(Zn2+/Zn)=-0.81В C(ZnCl2) = 0.07 м. a(ZnCl2) =?. | E(Zn2+/Zn) = Eo(Zn2+/Zn) +  = -0.76 + (0.059/2) * lg(i*0.07) = -0.81, следовательно, i = 1.8. a = (i-1)(m-1) = (1.8-1)/(2-1) = 0.8 = 80%, где m – количество ионов, на которые диссоциирует электролит. = -0.76 + (0.059/2) * lg(i*0.07) = -0.81, следовательно, i = 1.8. a = (i-1)(m-1) = (1.8-1)/(2-1) = 0.8 = 80%, где m – количество ионов, на которые диссоциирует электролит.
|
| Дано: E(Ag+/Ag) = 0.59 В S(Ag2CrO4) =?. | E(Ag+/Ag) = Eo(Ag+/Ag) +  = 0.8 + 0.059*lg[Ag+] = 0.59, следовательно, [Ag+] = 2.8*10-4 м. S = = 0.8 + 0.059*lg[Ag+] = 0.59, следовательно, [Ag+] = 2.8*10-4 м. S =  = 1.66*10-2 = 1.66*10-2
|
| Дано: E(Ag+/Ag)=0.51 В ПР(AgСl) =?. | E(Ag+/Ag) = Eo(Ag+/Ag) +  = 0.8 + 0.059*lg[Ag+] = 0.51, следовательно, [Ag+] = S = 1.2*10-5 м. ПР = S2 = 1.47*10-10 (S-растворимость) = 0.8 + 0.059*lg[Ag+] = 0.51, следовательно, [Ag+] = S = 1.2*10-5 м. ПР = S2 = 1.47*10-10 (S-растворимость)
|
| (-)Mg|Mg2+||Ag+|Ag(+) E = E0(Ag+/Ag) - E0(Mg2+/Mg) = 0.8 + 2.37 = 3.17 B ΔG0 = -zFE = -2*96500*3.17 = -611.81 кДж/моль ΔG0 = -RTlnKp = 8.31*298*lnKp = 611.81, следовательно, Кр = 1.28 |
| (-)Fe|Fe2+||Cu2+|Cu(+) E = E0(Cu+2/Cu) - E0(Fe2+/Fe) = 0.34 - (-0.45) = 0.79 B ΔG0 = -zFE = -2*96500*0.79 = -152.5 кДж/моль ΔG0 = -RTlnKp = 8.31*298*lnKp = 152.5, следовательно, Кр = 5.5*1026. |
| Дано: Cм(FeSO4)=1м. ЭДС = 0 В. Cм(CdSO4) =?. | (-)Fe|FeSO4||CdSO4|Cd(+)
ЭДС = E(Fe2+/Fe) - E(Cd2+/Cd) = E0(Fe2+/Fe) - E0(Cd2+/Cd) + 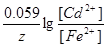 .
0= -0.40 + 0.45 + .
0= -0.40 + 0.45 +  , следовательно, [Cd2+] = Cм(CdSO4) =0.02 м. , следовательно, [Cd2+] = Cм(CdSO4) =0.02 м.
|
740. Э ДС гальванических элементов вычисляется как разница между потенциалом катода и потенциалом анода, например, для элемента (-)Fe|FeSO4||CdSO4|Cd(+) ЭДС = E0(Fe2+/Fe) - E0(Cd2+/Cd) + 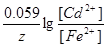 . Видно, что к увеличению ЭДС приведет увеличение концентрации катионов у катода и уменьшение концентрации катионов у анода, а к уменьшению ЭЛС – наоборот.
. Видно, что к увеличению ЭДС приведет увеличение концентрации катионов у катода и уменьшение концентрации катионов у анода, а к уменьшению ЭЛС – наоборот.
|
|
|
741. Электролиз – окислительно-восстановительные процессы, протекающие в расплавах и растворах под действием электрического тока. Устройство для осуществления электролиза называется электролизером. Электролизер представляет собой ванну, в которую погружены электроды: анод и катод.
    (-) Катод эл. ток Анод (+) (-) Катод эл. ток Анод (+)
 электролит
электролит
|
Пример: электролиз расплава хлорида натрия. Катодный процесс – восстановление ионов натрия до металлического натрия: Na+ + 1e = Na, анодный процесс – окисление ионов хлора до свободных атомов и рекомбинация последних в молекулы: 2Сl- -2e = Cl2.
742. Процессы электролиза начинают протекать при достижении определенного внешнего напряжения, называемого напряжением разложения. Напряжение разложения численно равно ЭДС гальванического элемента, образующегося при электролизе в результате выделения продуктов на электродах. Еще напряжение разложения можно определить экспериментально. Пример: электролиз расплава хлорида натрия. Катод покрывается слоем натрия, анод – слоем хлора, поэтому их можно рассматривать как натриевый и хлорный электроды, образующие гальваническую цепь. (-)Na|NaCl|Cl(+). Стандартный электродный потенциал натрия равен –2.71 В, а хлора +1.36В, поэтому ЭДС образованного ими элемента равна 4.07В. Следовательно, чтобы вызвать электролиз, следует приложить внешнее напряжение не менее 4.07В.
743. Процессы электролиза начинают протекать при достижении определенного внешнего напряжения, называемого напряжением разложения (перенапряжения). Напряжение разложения численно равно ЭДС гальванического элемента, образующегося при электролизе в результате выделения продуктов на электродах. Явление перенапряжения нежелательно потому, что оно приводит к повышенному расходу электроэнергии. Иногда это явление оказывается полезным и позволяет провести такие процессы, которые без перенапряжения не ведут к желаемому результату. Например, гальваническое хромирование возможно потому, что наряду с влиянием концентрации электролита влияние на процесс электролиза оказывает еще и перенапряжение водорода.
|
|
|
744. Если электродный потенциал металла гораздо меньше водородного потенциала, то на катоде выделяется только водород. Если электродный потенциал металла гораздо больше водородного потенциала, то на катоде выделяется только металл. Если электродный потенциал металла (Sn, Pb и др.) в растворе близок к водородному, то на катоде одновременно выделяются металл и водород.
745. Из анионов в водных растворах электролитов при электролизе не разряжаются анионы кислородных кислот (SO42- , NO3- и др.), т.к. электроны в них связаны прочнее и вместо них на аноде разряжаются ОН- или молекулы воды: 4ОН- + 4е - = 2Н2О + О2, 2Н2О – 4е - = 4Н+ + О2. В обоих случаях на аноде выделяется кислород. Окисление самого анода происходит в том случае, когда анод содержит те же катионы, которые содержатся в растворе соли.
746. Разряд катионов металлов на катоде при электролизе сопровождается присоединением электронов, следовательно, катионы металлов проявляют в этом процессе окислительную способность. Исходя из свойств ряда напряжений, в первую очередь будут разряжаться самые неактивные металлы - сначала золото, затем платина и т.д. Если электролиз ведется в расплаве, то после меди разряжаются катионы свинца, затем олова, никеля и т.д. до калия. Особенностью электролиза растворов является наличие в них, наряду с ионами электролита, ионов водорода за счет диссоциации воды. В этом случае неактивные металлы (Cu-Au), стоящие в ряду напряжений после водорода легко восстанавливаются из растворов, а активные металлы (Na-Al) не восстанавливаются совсем. Вместо них на катоде идет разрядка ионов водорода (если среда кислая) 2Н+ + е- = Н2 или молекул воды (нейтральная или щелочная) 2Н2О + 2е- = 2ОН- + Н2. Металлы, расположенные между алюминием и водородом (Mn-Pb) за счет изменения потенциала водорода в воде, также восстанавливаются из растворов. Из анионов в водных растворах в первую очередь разряжаются анионы бескислородных кислот Cl-, Br-, I-, S2- и другие, (кроме F-). В анионах кислородных кислот электроны связаны прочнее, поэтому вместо них на аноде разряжаются анионы ОН- в щелочной среде 4ОН- - 4е- = 2Н2О + О2, или молекулы воды в нейтральной и кислой средах 2Н2О – 4е- = 4Н+ + О2. Анионы, не разряжающиеся при электролизе растворов, разряжаются при электролизе расплавов. При этом из расплавленных фторидов на аноде выделяется газообразный фтор, а при электролизе сульфатов, нитратов и т.п. различные продукты, состав которых зависит от условий проведения процесса.
747. Количественная характеристика электролиза описывается формулами: 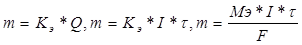 , где m - граммы,
, где m - граммы, 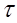 - секунды, F = 96500, I - амперы, Мэ - г/моль. Электролиз CuSO4 + H2O = Cu + H2SO4 + 1/2O2
- секунды, F = 96500, I - амперы, Мэ - г/моль. Электролиз CuSO4 + H2O = Cu + H2SO4 + 1/2O2
| Катод: Cu2+ + 2e- = Cu Анод: H2O – 2e- = 2H+ + 1/2O2 | m(Cu) =  = (32*20*12*3600*90%)/(96500*100%) = 258.7 грамм = (32*20*12*3600*90%)/(96500*100%) = 258.7 грамм
|
748. Приведенные формулы идентичны, поскольку 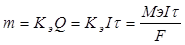 . Формулы идентичны при размерностях: m - граммы,
. Формулы идентичны при размерностях: m - граммы, 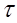 - секунды, F = 96500, I - амперы, Мэ - г/моль.
- секунды, F = 96500, I - амперы, Мэ - г/моль.
749. Постоянная Фарадея F = 96487 Кл – количество электричества, выделяющее при электролизе один грамм-эквивалент любого вещества. Электрохимический эквивалент Кэ численно равен массе вещества, выделившейся при действии одного кулона электричества. Кэ = Э/F. Для меди Кэ = 32/96487 = 3.32*10-4 г., для серебра Кэ = 108/96487 = 1.12*10-3 г., для NaOH Кэ = 40/96487 = 4.14*10-4 г.
750. Затраченное на электролиз электричество расходуется не только на целевую реакцию, но и на побочные процессы – окисление примесей и др. Поэтому масса вещества оказывается меньше теоретически рассчитанной. Отношение масс называется выходом по току.
751. Электролиз CuSO4 + H2O = Cu + H2SO4 + 1/2O2
| Катод: Cu2+ + 2e- = Cu Анод: H2O – 2e- = 2H+ + 1/2O2 | m(Cu) =  = (32*20*12*3600*90%)/(96500*100%) = 258.7 грамм = (32*20*12*3600*90%)/(96500*100%) = 258.7 грамм
|
752. Электролиз ZnSO4
| Катод: Zn2+ + 2е = Zn, Aнод: Н2О – 2е - = 2Н+ + 0.5О2. Суммарная реакция: ZnSO4 + Н2О = Zn + Н2SO4 + 0.5О2 | |
| Дано t = 10 часов = 36000 сек. Вт = 50%, I = 50 А. m(Zn) =? | m(Zn) =  310 грамм 310 грамм
|
753. Электролиз FeSO4
| Катод: Fe2+ + 2е = Fe, Aнод: Н2О – 2е - = 2Н+ + 0.5О2. Суммарная реакция: FeSO4 + Н2О = Fe + Н2SO4 + 0.5О2 | |
| Дано t = 5 часов = 18000 сек. Вт = 70%, I = 20 А. m(Zn) =? | m(Fe) =  73 грамма 73 грамма
|
754. Электролиз CuSO4
| Катод: Cu2+ + 2е = Cu, Aнод: Н2О – 2е - = 2Н+ + 0.5О2. Суммарная реакция: CuSO4 + Н2О = Cu + Н2SO4 + 0.5О2 | |
| Дано V(O2) = 5,64 л, Вт = 100% m(Cu) =? | Мэ(Cu) = 64/2 = 32 г/моль
 , следовательно, m(Cu) = 32*5.64/5.64 =32 грамма , следовательно, m(Cu) = 32*5.64/5.64 =32 грамма
|
755. Электролиз ZnSO4
| Катод: Zn2+ + 2е = Zn, Aнод: Н2О – 2е - = 2Н+ + 0.5О2. Суммарная реакция: ZnSO4 + Н2О = Zn + Н2SO4 + 0.5О2 | |
| Дано t = 6,7 часа = 24120 секунд V(O2) = 5,6 л, Вт = 70% I =? | V(О2) =  I=5.7A. I=5.7A.
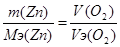 , следовательно, m(Zn) = 32.7*5.6/5.6 =32.7 грамма , следовательно, m(Zn) = 32.7*5.6/5.6 =32.7 грамма
|
756. Электролиз K2SO4
| Катод: 2Н2О + 2е = 2ОН- + Н2 анод: Н2О – 2е - = 2Н+ + 0.5О2. Суммарная реакция: Н2О = Н2 + 0.5О2 | |
| Дано I = 26.8 A t = 10часа = 36000 секунд Вт = 100% | V(H2) =  V(O2) = 1/2V(H2) = 5 литров
V(O2) = 1/2V(H2) = 5 литров
|
757. Электролиз раствора КОН.
| Катод: 2Н2О + 2е = 2ОН- + Н2 анод: 4ОН- - 4е = 2Н2О + О2 Суммарная реакция Н2О = Н2 + 1/2О2 | |
| Дано I = 13.4 A t = 2часа = 7200 секунд Вт = 100% | V(H2) =  V(O2) = 1/2V(H2) = 0.5 литра
V(O2) = 1/2V(H2) = 0.5 литра
|
758. Электролиз раствора Na2SO4
| Катод: 2Н2О + 2е = 2ОН- + Н2, Na+ + OH- = NaOH анод: Н2О – 2е - = 2Н+ + 0.5О2, 2Н+ + SO42- = H2SO4 Суммарная реакция: Н2О = Н2 + 0.5О2 | |
| Дано V(O2) = 11.2 л m (H2SO4) =? |  , m(H2SO4) = (11.2*49) / 5.6 = 98 г. , m(H2SO4) = (11.2*49) / 5.6 = 98 г.
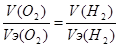 , V(H2) = (11.2*11.2) / 5.6 = 22.4 л. , V(H2) = (11.2*11.2) / 5.6 = 22.4 л.
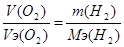 , m(H2) = (11.2*1) / 5.6 = 2 г. , m(H2) = (11.2*1) / 5.6 = 2 г.
|
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 871; Нарушение авторских прав?; Мы поможем в написании вашей работы!