
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електрохімічні методи аналізу
|
|
|
|
Можливості і практичне застосування
ІЧ-спектроскопія – метод ідентифікації і дослідження будови органічних і деяких неорганічних сполук. По ІЧ-спектрах можна зробити висновок про склад багатокомпонентних систем без іх хімічного розділення чи ідентифікув-авти індивідуальні речовини. Методом ІЧ-спектроскопії в харчових продуктах визначається вміст шкідливих жирів з транс-ізомерними жирними кислотами (жири з ненасиченими жирними кислотами, які в процесах гідрогенізації чи ізомерізації змінили цис-конфігурацію –СН=СН– груп ненасичених жирних кислот на транс конфігурацію). Визначення здійснюється по смузі поглинання з максимумом при 966 см‑ 1, що відноситься до несиметричних коливань зв'язку С-Н групи -СН=СН– з транс-розташуванням замісників. Слід відзначити, що завдяки достатньо високої границі визначення (10 – 0.1 %) і невеликої точністі результатів (> 5 %) можливості використання ІЧ-спектроскопії в кількісному аналізі обмежено.
Ці методи засновані на вимірюванні та реєстрації електричних параметрів систем, що аналізуються (кількость електрики, яка пройшла через розчин електроліту; електрична провідність або електричний опір; потенціал електроду, який знаходиться в аналізуємому розчині та ін.). Їх можна поділити на дві групи: 1) без застосування зовнішнього джерела електричного струму (потенціометрія, іонометрія). 2) з застосуванням зовнішнього джерела електричного струму (низькочастотна і високочастотна кондуктометрія, кулонометрія, вольтамперометрія (полярографія), амперометрія);
ПОТЕНЦІОМЕТРІЯ (ІОНОМЕТРІЯ)
Потенціометрія - електрохімічний метод дослідження та аналізу, який базується на на залежності електрохімічного потенціалу електроду від концентрації (активності) іонів які визначаються. Зв,язок потенціалу електроду Е з активністю (концентрацією) речовин, які приймають участь в електродних процесах, описується рівнянням Нернста
|
|
|
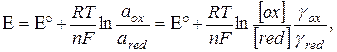
де Е0 – стандартний потенціал редокс-системи; R - універсальна газова стала, яка дорівнює 8,312 Дж / моль; Т - абсолютна температура, 0 К; F - стала Фарадея, яка дорівнює 96500 Кл/моль; n - число електронів, що приймають участь в електродній реакції; аох, аred – активності окисленої і відновленої форм редокс-системи, відповідно, моль/л; [ох], [red] - молярні концентрації окисленої і відновленої форм редокс-системи, моль/л; γох, γred – коефіцієнти активності.
В розбавлених розчинах коефіцієнти активності іонів близькі до одиниці і відповідно активність близька до молярної концентрації, тому можна користуватися рівнянням Нернста в концентраційній формі, а саме: 

Схема методу наступна: в аналізуємий розчин занярюють два електроди і вимірюють різницю їх потенціалів (ЕРС гальванічного елементу). Один з електродів має сталий потенціал незалежно від природи розчину, в який його занурено (електрод порівняння). Потенціал другого електроду залежитьвід концентрації електроліту в розчині (індикаторний електрод).
φ = Е1 – Е2
де φ –електрорушійна сила гальванічного елементу (ЕРС); Е1 і Е2 – потенціали індикаторного електроду та електроду порівняння. Оскільки потенціал електроду порівняння сталий, то зміна ЕРС визначається потенціалом індикаторного електрода.
Якщо індикаторний електрод сам є одним з компонентів окисно-відновної системи, то величина потенціалу електрода буде визначатися лише концентрацією іонів металу в розчині. Наприклад, деякі метали, занурені в розчин солі цього ж металу, здатні осаджувати іони з розчину і таким чином утворювати окисно-відновну систему:
|
|
|

Вважаючи, що концентрація (активність) металу дорівнює одиниці, рівняння Нернста для цієї системи матиме вигляд:
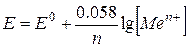 .
.
З рівняння бачимо, що в даному випадку потенціал електроду залежить лише від концентрації катіона металу в розчині. Електроди такого типу називають електродами першого роду; до них належать, наприклад, срібний, ртутний, водневий електроди.
Поряд з електродами першого роду існують електроди чутливі до концентрації аніонів, що утворюють малорозчинні осади з катіонами металу електрода. Подібни електроди, потенціал яких визначається концентрацією відповідних аніонів, називаються електродами другого роду. Вони представляють собою метал, вкритий шаром малорозчинної солі цього ж металу. Потенціал електроду другого роду визначаеться рівнянням:
 .
.
Електродами другого роду є хлорсрібний і ка ломельний.
Широко розповсюджені електроди третього роду - мембранні або іоно-селективні електроди. Мембраннні електроди - це електрохімічні напівелемен ти, в яких різниця потенціалів на межі розділу фаз “електродний матеріал – розчин електроліту” залежить від концентрації (активності) іона, що визнача-ється, в розчині. Електродний матеріал являє собою тверду або рідку мембрану, в яку введена речовина, здатна відщеплювати або приєднувати іони, що визна-чаються. Ці іони при зіткненні з водою або з водяним розчином електроліту здатні переходити в нього. Іноді, навпаки, іони з розчину проникають у мембра-ну. У результаті поверхня мембрани здобуває заряд, протилежний заряду іонів, що перейшли в розчин, і на межі розділу фаз виникає потенціал, величина якого залежить від активності даних іонів у розчині. Тобто найважливішою складовою частиною такого електроду є напівпроникна мембрана. Оскільки потенціал мембранних електродів створюють іони певного виду, то їх називають іоноселективними. електродами. Іоноселективні електроди відповідно до природи електродно-активного матеріалу можуть містити: тверду рідку, газову або ферментну мембрани.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 800; Нарушение авторских прав?; Мы поможем в написании вашей работы!