
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Насичена і ненасичена пара
|
|
|
|
Добре картина випаровування спостерігається тоді,коли рідини перебути: в закритій посудині і займає лише частину її об'єму. На початку процесу кількість молекул, які вилітають з рідини, перевищує кількість молекул, які знову повертаються в неї, і концентрація молекул пари зростає. Але чим більше стає молекул, які вилетіли з рідини, тим більше їх потрапляє назад у рідину. Нарешті настає такий момент, коли кількість молекул, які вилітають з рідини за одиницю часу, виявляється такою самою, як і кількість молекул, що повертаються в неї за той самий час. Очевидно, починаючи з цього моменту, концентрація молекул пари буде сталою. Такий стан називають динамічною рівновагою рідини і пари. Пару, що знаходиться в тепловій динамічній рівновазі зі своєю рідиною, називають насиченою. Зрідка вдається одержати насичену пару і у відчинених посудинах.
Тиск насиченої пари наближено можна розрахувати за виразом основного рівняння МКТ:
p = nkT.
Оскільки концентрація  молекул насиченої пари не залежить від об'єму за сталої температури, то і тиск насиченої пари не залежить від об'єму, а залежить від температури. Ці закономірності встановлено експериментально. З підвищенням температури тиск насиченої пари зростає швидше, ніж тиск ідеального газу (мал. 1, ділянка АВ), бо під час нагрівання тиск насиченої пари збільшується не тільки через підвищення температури, а й унаслідок збільшення концентрації молекул (густини) пари.
молекул насиченої пари не залежить від об'єму за сталої температури, то і тиск насиченої пари не залежить від об'єму, а залежить від температури. Ці закономірності встановлено експериментально. З підвищенням температури тиск насиченої пари зростає швидше, ніж тиск ідеального газу (мал. 1, ділянка АВ), бо під час нагрівання тиск насиченої пари збільшується не тільки через підвищення температури, а й унаслідок збільшення концентрації молекул (густини) пари.
Мал.1
Коли вся рідина випарується, пара за подальшого нагрівання стане вже ненасиченою і її тиск за сталого об'єму зростатиме прямо пропорційно абсолютній температурі (мал. 1, ділянка ВС).
Описати стан ненасиченої пари можна використовуючи закони ідеального газу, а стан насиченої пари - за рівнянням Клапейрона-Менделеєва за низьких температур і малих концентрацій:
|
|
|
 (1)
(1)
де p 0 і r0 - відповідно тиск і густина насиченої пари.
У міру збільшення температури рідини інтенсивність випаровування збільшується. Випаровування відбувається за будь-якої температури. Особливим видом випаровування є процес кипіння.
Кипіння - процес утворення пари не тільки на поверхні рідини, а і в її об'ємі. У рідині завжди містяться бульбашки розчиненого в ній газу, вони заповнені насиченою парою. За звичайної температури тиск насиченої пари бульбашок набагато менший від зовнішнього тиску, тому ці бульбашки сплюснуті і мають мікроскопічні розміри:
p атм + r gh + p кр > p нас,
де p атм - атмосферний тиск; r gh - гідростатичний тиск рідини; p кр - тиск, зумовлений кривизною поверхні бульбашки (тиск Лапласа).
З підвищенням температури тиск насиченої пари в бульбашці зростає (p = nkT). За деякої граничної температури для кожної рідини, яку називають температурою кипіння, тиск пари всередині бульбашок переважає зовнішній, внаслідок чого бульбашки збільшуються в об'ємі і під дією сили Архімеда спливають на поверхню та лопаються (мал. 2). На місці цих бульбашок утворюються інші, і вся рідина закипає. Кипіння починається вже при температурі, що відповідає рівності p нас = p зовн. Чим більший зовнішній тиск, тим вищою буде температура кипіння і навпаки. Кожна рідина має свою температуру кипіння, яка залежить від тиску насиченої пари. Чим більший тиск насиченої пари, тим менша температура кипіння. Чим менший тиск насиченої пари, тим більша температура кипіння.

Мал. 2
Завдяки якісній обробці поверхонь посудини та очищенню самої рідини можна досягти практичної відсутності в ній центрів пароутворення, що призводить до того, що кипіння не відбувається навіть за температур вищих від температури кипіння. Таку рідину називають перегрітою.
|
|
|
Важлива характеристика процесів випаровування і конденсації - питома теплота пароутворення. Це фізична скалярна величина r, що чисельно дорівнює кількості теплоти, потрібної для перетворення 1 кг рідини в пару при температурі її кипіння. Її в СІ вимірюють у джоулях на кілограм; [ r ] = Дж/кг.
Питому теплоту пароутворення можна визначити не тільки при температурі кипіння, а й під час пароутворення за будь-якої температури. У цьому разі питома теплота пароутворення буде залежною від температури.
Для випаровування рідини масою m їй треба надати кількість теплоти:
Q = rm.
Під час конденсації 1 кг пари буде виділятися теплота, що чисельно дорівнює кількості теплоти пароутворення з 1 кг рідини.
З підвищенням температури рідини зростає тиск насиченої пари і одночасно зростає її густина r0, а густина рідини зменшується rp. За деякої температури, яку називають критичною, r0 = rp (мал.3.).
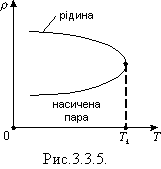
Мал. 3
Критична температура - це температура, за якої зникає відмінність у фізичних властивостях рідини й її насиченої пари. Цей стан називають критичним станом речовини. В Україні вперше дослідив цей стан професор Київського університету М. П. Авенаріус за методом зникнення меніска.
У разі критичної температури густина і тиск насиченої пари стають максимальними, а густина рідини, що перебуває в рівновазі з парою, - мінімальною. Питома теплота пароутворення зменшується із зростання температури і за критичної температури дорівнює нулю.
Кожна речовина має свою критичну температуру. Наприклад, критична температура води приблизно дорівнює 375 оС.
Особливе значення критичної температури полягає в тому, що якщо температури вищі за критичну, газ не можна перетворити в рідину ні за яких значень тиску.
Приклад розв’язування задачі:
Закриту посудину об’ємом 0,5м3, яка містить 0,5кг води, нагріли до 1500С. Як треба змінити об’єм посудини, щоб пара у ній стала насиченою? (тиск насиченої пари при 1500С становить 4,7·104 Па).
Розв’язання:


Тому потрібно збільшити об’єм посудини до 2,07м3.
Відповідь: V2=2,07 м3.
 Питання для самоперевірки:
Питання для самоперевірки:
1.Що відбувається при процесі пароутворення?
2.Що відбувається при процесі конденсації?
3. Яка пара називається насиченою?
|
|
|
4.Яка пара є ненасиченою?
Методичні вказівки до розв’язування задач з розділу «Молекулярна фізика»
Задачі на розрахунок параметрів стану ідеального газу можна розподілити на дві основні групи. До першої групи належать задачі, в яких у разі зміни будь-якого з параметрів маса ідеального газу залишається сталою. Причому маса газу може бути не заданою. Тоді задачі можна розв'язувати за об'єднаним газовим законом, частинним випадком якого залежно від сталих параметрів є закони Бойля-Маріотта, Гей-Люссака, Шарля.До другої групи належать задачі із заданою або змінною масою. До них застосовний закон Менделєєва-Клапейрона, причому його записують для кожного стану ідеальних газів. Одержану систему рівнянь з урахуванням додаткових умов розв'язують відносно шуканої величини.
 Завдання для самоперевірки:
Завдання для самоперевірки:
1. Скільки треба затратити теплоти, щоб 0,5кг води при температурі
200С довести до температури кипіння і перетворити у пару?
2. Закриту посудину об’ємом 0,8м3, яка містить 1кг води, нагріли до 1200С. Як треба змінити об’єм посудини, щоб пара у ній стала насиченою?
 ТЕМА 4
ТЕМА 4
Розділ: Молекулярна фізика.
Тема: Властивості твердих тіл
Мета вивчення: ознайомлення зі структурою, властивостями та застосування рідких кристалів.
План вивчення:
1.Рідкі кристали - структура, властивості, використання.
2.Створення матеріалів із наперед заданими технічними властивостями.
3. Будова полімерів та їх властивості.
1. Рідкі кристали
Більшість речовин може перебувати в трьох агрегатних станах — твердому, рідкому й газоподібному. Однак деякі органічні речовини, молекули яких мають ниткоподібну форму або форму плоских пластин, можуть перебувати в особливому стані, маючи одночасно властивості анізотропії і текучості. Цей стан, який поєднує властивості кристала і рідини, називають рідкокристалічним. А речовини, які досить дивовижно поєднують властивості рідин і кристалів, дістали назву рідких кристалів. Вони текучі і утворюють краплі. Правда, їхні краплі можуть мати не сферичну, а видовжену форму. Детальне дослідження показало, що розміщення молекул у них має порядок, не властивий звичайним рідинам і твердим тілам. Якщо в твердих кристалах спостерігається дальній порядок у розміщенні частинок в будь-яких трьох взаємно перпендикулярних напрямах, то в рідких — в одному напрямі (одновісний дальній порядок).
|
|
|
Маючи впорядковану орієнтацію молекул в одному з напрямів, рідкі кристали характеризуються анізотропією фізичних властивостей: поверхневого натягу, електропровідності, магнітних і оптичних характеристик тощо. За механічними властивостями вони нагадують рідини, в'язкість яких коливається від рідкого клею до «твердого» скла.
Існують рідкі кристали в певному інтервалі температур, різному для різних речовин. Нагріваючись, вони перетворюються у звичайну рідину, від охолодження стають твердими кристалами. Розрізняють два основних типи рідких кристалів: нематичнйи (від грецького «нема» — нитка) і смектичний (від грецького «смекма» — мило). В нематичних рідких кристалах впорядкованість розташування молекул полягає в тому, що в певному об'ємі, який відповідає одному «монокристалу», поздовжні осі всіх молекул паралельні, а будь-який інший дальній порядок у розміщенні частинок відсутній. У смектичних рідких кристалах молекули розташовані шарами. Найпоширеніший приклад смектичного рідкого кристала — розчин мила у воді. Ті якості мила, які роблять його мийним засобом, безпосередньо пов'язані з його здатністю утворювати рідкі кристали. Мильний розчин складається з великої кількості подвійних шарів молекул мила, розділених шарами води. Коли ми миємо з милом руки, то шари молекул мила легко ковзають один відносно одного і шкіри, забираючи з неї бруд і передаючи його воді.
Вже вивчено понад 3000 речовин, які утворюють рідкі кристали. До них належить багато органічних речовин біологічного походження, наприклад дезоксирибонуклеїнова кислота, яка несе код спадкової інформації, і речовина мозку.
Багато рідких кристалів мають дуже цінну якість: деякі їх властивості різко змінюються за порівняно незначної зміни зовнішніх умов (температури, електричного і магнітного полів тощо). Це явище знайшло вже практичне застосування: на основі рідких кристалів опрацьовано перетворювач інфрачервоного зображення у видиме, лабораторний прилад для вимірювання коливань температури і т. ін.
Рідкі кристали використовуються в різних оптичних індикаторах, наприклад у циферблатах наручних годинників, на яких час фіксується не стрілкою, а зміною цифр
Надзвичайно велике значення рідких кристалів у біології та медицині. Немає сумнівів у тому, що дальші дослідження цих речовин не тільки розширять їх застосування в техніці, а й дадуть змогу проникнути в таємниці біологічних процесів.
2. Створення матеріалів із наперед заданими технічними властивостями
Останнім часом у багатьох галузях народного господарства зростають потреби в економічних і високоякісних матеріалах, що мають певні технічні властивості. Для науки й техніки потрібні матеріали досить міцні та особливо стійкі проти нагрівання, дії хімічних реагентів, корозії. В авіації, ракетній, космічній і ядерній техніці, радіоелектроніці прогрес був би просто неможливий без надміцних матеріалів, здатних витримувати температури до 2500 °С і вище.
Багато з використовуваних у техніці матеріалів не існує в природному стані — їх створила людина. В сучасній техніці використовується понад 20 тисяч конструкційних і будівельних матеріалів, і їх асортимент з кожним роком зростає за рахунок створення надміцних, жаростійких, хімічно стійких матеріалів та їх сплавів. Але якщо раніше нові матеріали створювалися в результаті простого відбору природних речовин із необхідними властивостями, то нині на основі знання залежності фізичних і хімічних властивостей речовини від її будови (структури) цілеспрямовано створюють матеріали із заздалегідь заданими механічними, тепловими, електромагнітними, оптичними та іншими властивостями.
Одним із засобів керування властивостями нових матеріалів є утворення різних сплавів. Сплавляючи в певному співвідношенні різні метали, дістають сплави з бажаними технічними властивостями. В розплавленому стані відбувається активне дифузійне перемішування частинок (іонів, атомів, молекул) вихідних речовин, яке у процесі кристалізації сприяє утворенню сплаву із властивостями, які відрізняються від властивостей його компонентів. Тепер виготовляються і використовуються тисячі металевих сплавів з різноманітними властивостями: дюралюміній (сплав алюмінію з міддю, магнієм і манганом), латунь (сплав міді з цинком), бронза (сплав міді з оловом, алюмінієм або свинцем), бабіт (сплав олова, стибію і міді), легована сталь (сплави заліза з нікелем, кобальтом, хромом та іншими металами) тощо. Тверді металеві сплави мають високу пластичність і міцність. Сплавляючи тугоплавкі метали (вольфрам, хром, ванадій, іридій, молібден тощо), дістають особливо тверді сплави, які використовують для виготовлення металорізального інструменту. На основі титану дістають легкі і надзвичайно міцні сплави, здатні працювати за температури 500—600 °С. За густини 4,5 • 103 кг/м3 титан має модуль пружності приблизно в 2 рази більший, ніж залізо, і в 6 раз більший, ніж алюміній. Ці якості титанових сплавів зробили їх незамінними в надзвуковій авіації, космічній техніці та інших галузях науки і техніки.
Для роботи у разі великих механічних навантажень використовувалися переважно метали та їх сплави. Однак метали непридатні в агресивних середовищах або за високих температур, оскільки зазнають корозії, а під час нагрівання стають пластичними і набувають плинності, тобто повільно і безперервно деформуються під впливом навантажень чи механічних напруг. З метою підвищення міцності металів у їх кристалічні решітки вводять атоми інших елементів, таких, як Карбон, Силіцій, Нітроген, Бор. В результаті дістають сполуки металів з Карбоном (карбіди), Силіцієм (силіциди), Бором (бориди), Нітрогеном (нітриди), які дістали назву металоподібних. Ці з'єднання, зберігаючи значною мірою властивості металів (міцність, електропровідність тощо), одночасно набувають і нових (твердість, теплостійкість, хімічна стійкість). Атоми металу і неметалу зв'язуються між собою дуже міцними ковалентно-металевими зв'язками.
Карбіди деяких металів (Титану, Цирконію, Гафнію, Ванадію, Танталу, Ніобію, Молібдену тощо) дуже тверді і тугоплавкі речовини. Підвищення цих цінних якостей досягається в результаті сплавляння між собою різних карбідів чи карбідів з металами: нікелем, кобальтом, хромом тощо. Так, деталі із сплаву карбідів танталу, гафнію і цирконію можуть працювати за температури до 3000 °С. Найтугоплавкішим з усіх відомих матеріалів є сплав карбідів танталу (80 %) і гафнію. Його температура плавлення дорівнює 4215 С.Металоподібні сполуки знаходять широке і різноманітне застосування у сучасній техніці: захисні покриття під час добування жароміцних волокон, в металургії, енергетиці тощо.
З кожним роком зростає застосування в техніці так званих бінарних сполук неметалів: Карбону, Силіцію, Нітрогену і Бору, тобто продуктів з'єднання між собою двох різних атомів цих елементів. В кристалічній структурі бінарних сполук атоми зв'язані міцними ковалентними зв'язками. Тому ці речовини відзначаються винятковою твердістю, термостійкістю, вогнетривкістю і хімічною стійкістю.
Прикладом такої бінарної сполуки є карбід силіцію БіС, який в техніці називають карборундом. Його дуже широко використовують для виготовлення абразивів, вогнетривів і напівпровідників. Ниткоподібні монокристали карбіду силіцію використовують для армування металів і полімерів та добування в такий спосіб винятково міцних матеріалів.
Дуже міцний ковалентний зв'язок утворюють атоми Бору і Нітрогену в кристалічній структурі нітриду бору N6, причому існують три різні форми кристалічних решіток, дві з яких аналогічні алмазу і графіту. Нітрид бору, кристалічна решітка якого схожа з графітом — це білий порошок («білий графіт»), слугує кращим, ніж графіт, змащенням. Нітрид бору, що має кристалічну решітку, аналогічну алмазу, за твердістю не поступається йому і перевищує його за міцністю і термостійкістю. В техніці цей матеріал називають ельбором, кубонітом або боразоном. Різальні й абразивні інструменти, виготовлені на основі ельбору, в 10—20 раз перевищують за стійкістю твердосплавні інструменти. Такими інструментами можна обробляти сталь і чавун, тоді'як алмазні інструменти для цієї мети непридатні: під час розігрівання алмаз перетворюється в графіт.
У багатьох галузях науки і техніки широко використовують чудові механічні, електромагнітні й оптичні властивості монокристалів хімічних елементів і багатьох речовин, насамперед алмазу, рубіну, германію, кварцу, силіцію, сапфіру, ісландського шпату тощо. Але, на жаль, ці монокристали трапляються в природі дуже рідко і в більшості випадків мають тріщини, забруднення, дефекти кристалічної структури. У зв'язку з цим швидкими темпами розвиваються техніка і технологія штучного вирощування, або синтезу монокристалів багатьох хімічних елементів і сполук дуже високої хімічної чистоти з досконалою кристалічною структурою.
В Україні виробляються сотні штучних кристалів, у тому числі дорогоцінних і напівдорогоцінних: діамантів, смарагдів, рубінів, гранатів, сапфірів, аметистів, топазів тощо. Вирощені штучні монокристали ні в чому не поступаються природним, а деякі і значно їх перевищують, оскільки в процесі їх виготовлення учені й інженери можуть цілеспрямовано змінювати склад вихідних речовин, умови вирощування і тим самим створювати монокристали з необхідними властивостями.
Існують два основні способи вирощування монокристалів: кристалізація із розплаву і кристалізація із розчину.
Великим досягненням науки й техніки останніх сорока років була організація промислового виробництва синтетичних алмазів. Вони виявилися кращими за природні: твердіші, менш крихкі і стійкіші проти зношування. Наприклад, алмазні підшипники, які працюють без змащення у хронометрах вищого класу для морських кораблів і в інших особливо точних навігаційних приладах, роблять 60 млн. обертів без помітного зношування. Синтетичні алмази у вигляді порошків, паст і дрібних кристалів також використовують у приладах і деталях, які вимагають великої твердості. їх застосовують для дуже точної обробки важливих деталей машин і приладів, виробів з твердої сталі, кераміки, природних алмазів. Алмазні різці, свердла, пилки, філь’єри і коронки в сотні і тисячі разів довговічніші за звичайні, при цьому обробка ними твердих сплавів і пластиків прискорюється в 6—12 раз. Глибоке буріння свердловин ведеться тепер майже виключно за допомогою алмазного інструменту.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 12453; Нарушение авторских прав?; Мы поможем в написании вашей работы!