
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчин, його склад. 1 страница
|
|
|
|
План
План
План
План
План
План
План
План
План
План
План
1. Основні положення атомно-молекулярного вчення.
- Прості і складні речовини. Відмінність між простою речовиною і хімічним елементом. *
- Агрегатний стан речовин
1. Основи АМВ вперше виклав М. В. Ломоносов. У 1741р. в праці «Елементи математичної хімії» Ломоносов сформулював найважливіші положення створеної ним так званої корпускулярної теорії будови речовини.
В основі АМВ лежить принцип дискретності (переливності будови) речовини: всяка речовина не є чимось суцільним, а складається з окремих, дуже малих частинок. Відмінність між речовинами зумовлена відмінністю між їхніми частинками; частинки однієї речовини однакові, частинки різних речовин різні.
Основні положення АМВ:
- Речовини складаються з атомів або молекул.
Атом – це найменша частинка хімічного елемента, яка є носієм його властивостей.
Молекула – це найменша частинка речовини, яка має її властивості і складається із сполучених між собою атомів. До складу молекули можуть входити атоми одного або кількох хімічних елементів. Число атомів у молекулі може становити від 2 до кількох мільйонів.
2. Всі молекули, атоми, що входять до складу речовини, перебувають у безперервному русі, який зумовлений запасом теплової енергії, яку має кожна речовина. Під час перебігу хімічних реакцій атоми переходять від одних речовин до інших (перегруповуються), внаслідок чого утворюються нові сполуки.
- Всі речовини поділяються на прості і складні.
2. Кожний окремий вид матерії, що має за певних умов сталі фізичні властивості називається речовиною.
Прості речовини складаються з атомів одного хімічного елемента. (Приклад: N2, O2, Fe)
|
|
|
Складні речовини складаються з атомів різних хімічних елементів. (Приклад: H2O, NaCl, NaOH)
Відмінність між простою речовиною і хімічним елементом стає особливо зрозумілою, коли маємо кілька простих речовин, які складаються з того самого елемента (явище алотропії). Наприклад, шматок фосфору. Це – біла, напівпрозора речовина, що плавиться при 44,2С, дуже отруйна; на повітрі в темряві фосфор світиться і може самозайматися. Якщо фосфор нагрівати без доступу повітря, то через деякий час його властивості різко зміняться: фосфор набуває червоно-фіолетового кольору, перестає світитися в темряві, стає неотруйним і не самозаймається більше на повітрі, причому ці нові властивості не зникають після припинення нагрівання. Отже, відбувається безперечне перетворення однієї речовини в іншу, перетворення особливе: взята нами речовина не розкладається і до неї нічого не приєднується. Це змушує визнати обидві речовини – взяту на початку і добуту після нагрівання – лише різними формами існування одного елемента фосфору у вільному стані; перша з них називається білим, а друга – червоним фосфором. Доказом того, що білий і червоний фосфор справді є різними формами одного елемента і складаються з однакових атомів, може бути відношення їх до кисню: утворюється фосфор(V) оксид. Просто їхні кристали мають різну будову. Так, білий фосфор складається з молекул Р4, а кристали червоного мають зовсім іншу, полімерну структуру.
3. Залежно від фізичних умов (температури і тиску) речовини можуть перебувати у кількох агрегатних станах: газоподібному, рідкому, твердому (кристалічному або аморфному), плазмовому.
У газах відстані між частинками – молекулами й атомами – великі. Внаслідок цього газоподібний стан характеризується слабкою взаємодією частинок і невпорядкованим їх розміщенням.
У рідинах частинки розміщені значно ближче одна до одної. Тому взаємодія між ними сильніша, ніж у газах. На відміну від газів рідини зберігають певний об’єм. Структура рідини характеризується певним порядком у розміщенні частинок, однак він постійно змінюється внаслідок теплового руху частинок.
|
|
|
Найбільш упорядкованим є кристалічний стан – найважливіший стан твердих тіл. Структуру кристалічних речовин можна подати за допомогою кристалічної ґратки – певного просторового розміщення частинок. Більшість твердих речовин мають кристалічні ґратки, утворені атомами або йонами; виділити окремі молекули у таких структурах неможливо. Такі речовини називають речовинами з не молекулярною структурою.
Менше поширений для твердих речовин аморфний стан. На відміну від кристалічних тіл речовини в аморфному стані не мають чітко регулярної впорядкованої будови і певної температури плавлення (при нагріванні вони розм’якшуються і поступово переходять у рідкий стан).
Контрольні запитання:
- Сформулюйте основні положення атомно-молекулярного вчення.
- Яка різниця між простими і складними речовинами? Навести приклади.
- Як довести відмінність між простими речовинами і хімічними елементами? Навести приклади.
- В яких агрегатних станах можуть перебувати речовини? Навести приклади.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. І, §§ 5, 6, с. 19-23.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 1, § 4, с. 6.
Тема 1.4. Періодичний закон і періодична система Д.І. Менделєєва
1. Періодичний закон.
- Періодична система, її будова.
- Зміна властивостей елементів в періодах і групах. *
1. На відміну від своїх попередників Менделєєв був впевнений, що між усіма хімічними елементами має існувати закономірний зв'язок, що об’єднує їх в єдине ціле, і зробив висновок, що в основу систематики елементів слід покласти їхню атомну масу, тобто величину, що характеризує відносну масу атома.
Справді, розмістивши всі елементи в порядку зростання атомних мас, Менделєєв виявив, що схожі з хімічного погляду елементи зустрічаються через правильні інтервали і що, отже в ряду елементів багато які властивості періодично повторюються.
Ця закономірність дістала назву Періодичний закон (1869р):
|
|
|
Властивості простих тіл, а також форми та властивості сполук елементів перебувають у періодичній залежності від величини атомних ваг(мас) елементів.
Сучасне формулювання:
Властивості хімічних елементів, а також простих і складних речовин, які вони утворюють, перебувають у періодичній залежності від величини заряду ядра атомів цих елементів.
2. ПС – графічне зображення періодичного закону.
Періодична система складається з 7 періодів і 8 груп. Кожна група складається з двох підгруп – головної і побічної.
Період – горизонтальний ряд хімічних елементів.
Група – вертикальний стовпчик хімічних елементів.
3. Зміна властивостей хімічних елементів в міру зростання їхньої атомної маси не відбувається неперервно в тому самому напрямі, а має періодичний характер. Через певне число елементів відбувається ніби повернення назад, до вихідних властивостей, після чого певною мірою знову повторюються властивості попередніх елементів в такій самій послідовності, але з деякими якісними і кількісними відмінами.
Властивості змінюються періодично, тому що періодично повторюється конфігурація зовнішнього рівня.
Атомний радіус характеризує міжатомний простір і дорівнює половині відстані між ядрами однакових атомів в молекулі.
Енергія іонізації – найменша енергія, яка необхідна для відриву електрона від нейтрального атома.
Спорідненість до електрону – енергія, яка виділяється або поглинається в разі приєднання до атому одного електрона.
Енергія іонізації і спорідненість до електрону співпадають, але відрізняються за знаком.
Електронегативнсть – здатність його атому притягувати спільні електронні пари порівняно з іншими елементами сполуки.
Таблиця. Періодичність зміни властивостей
| Властивість | В періоді (зліва направо) | В групі (згори вниз) |
| Атомний радіус | ↓(оскільки заряд ядра ↑, кількість електронів ↑) | ↑(оскільки число енергетичних рівнів ↑) |
| Енергія іонізації | ↑(зростає притягання електронів зовнішнього рівня) | ↓(зменшується притягання між електронами зовнішнього рівня і ядром) |
| Спорідненість до електрону | ↑ | ↓ |
| Електронегативність | ↑ | ↓ |
Контрольні запитання:
|
|
|
- Сформулюйте періодичний закон.
- Будова періодичної системи.
- Чому властивості елементів змінюються періодично?
- Як змінюються основні характеристики елементів у групах (у періодах)?
- Охарактеризуйте будову атомів елементів алюмінію і титану за положенням в ПС.
- Як зміняться властивості в ряду B – Al – Ga – In – Tl?
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. ІІ, §§ 17-19 с. 47-56.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 2, §§ 7-8, 13, 15-17, с. 14-16, 20-27.
Тема 1.5. Хімічний зв'язок.
1. Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- Ковалентний зв'язок. *
- Йонний зв'язок. *
- Металічний зв'язок.
1. Хімічний зв'язок – взаємодія атомів, яка приводить до утворення хімічно стійкої двох- або багатоатомної системи (молекули або кристалу).
Природа хімічного зв’язку має електростатичний характер.
Типи хімічного зв’язку

2. Ковалентний зв’язок – це зв'язок, що утворюється за рахунок спільних електронних пар.
Природа ковалентного зв’язку визначається силою електростатичного притягання двох сусідніх ядер до пари електронів, розташованої між ними.
Існує 2 погляди на розгляд механізму утворення хімічного зв’язку:
- метод валентних зв’язків (МВЗ)
- метод молекулярних орбіталей (ММО)
МВЗ дав теоретичне пояснення найважливіших властивостей ковалентного зв’язку, дав змогу зрозуміти будову великої кількості молекул.
В основі МВЗ лежать такі положення:
1. Ковалентний хімічний зв'язок утворюється 2 електронами з протилежно напрямленими спінами, причому ця електронна пара належить двом атомам.
2. Ковалентний зв'язок тим міцніший, чим більшою мірою перекриваються взаємодіючі електронні хмари.
Перекривання можливе тільки при певній взаємній орієнтації електронних хмар; при цьому область перекривання розміщується в певному напрямі відносно взаємодіючих атомів. Тобто ковалентний зв'язок має певну напрямленість:
σ - зв'язок (перекривання атомних хмар відбувається поблизу прямої, що сполучає ядра взаємодіючих атомів)
π – зв’язок (перекривання атомних хмар відбувається з обох боків від прямої, що сполучає ядра взаємодіючих атомів).
Найчастіше ковалентний зв'язок утворюється за обмінним механізмом. Сутність обмінного механізму полягає в тому, що кожний атом надає по 1 електрону для спільної електронної пари.
Приклад: 1) Н2
H∙ + ∙H → H: H або H – H
2) HCl
H∙ + ∙Cl: → H:Cl: або H – Cl
Ковалентний зв'язок за полярністю (симетричністю розташування електронної пари відносно атомів) поділяється на ковалентний полярний та ковалентний неполярний.
Ковалентний неполярний зв’язок – зв'язок, утворений атомами з однаковою електронегативністю.
Приклад: Н2, О2, N2
Ковалентний полярний зв’язок – зв'язок, утворений атомами, електронегативності яких мало відрізняються.
Приклад: HCl, H2O
Крім цього зв'язок може утворюватися і за донорно-акцепторним механізмом: один атом (акцептор) дає вільну орбіталь, а другий (донор) віддає неподілену пару електронів.
Приклад: NH4+
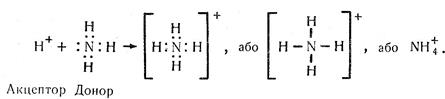
3. Йонний зв'язок – хімічний зв'язок між йонами.
Природа йонного зв’язку полягає в електростатичному притяганні протилежнозаряджених йонів.
Приклад: NaF
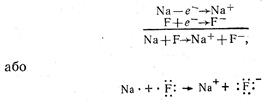
Відмінність йонного зв’язку від ковалентного:
- не має напрямленості
- не має насичуваності
Властивості речовин залежать від типи зв’язку:
1) речовини з ковалентним неполярним зв’язком краще розчиняються в неполярних розчинниках
2) речовини з ковалентним полярним зв’язком гарно проводять електричний струм; добре розчиняються в полярних розчинниках.
3) речовини з йонним зв’язком мають високі температури кипіння і плавлення; високу електропровідність у розчинах і розплавах.
4. Металічний зв'язок утворюється внаслідок електростатичного притягання між йонами металу та вільними електронами.
Приклад: Атом натрію на останньому енергетичному рівні містить чотири орбіта лі й один валентний електрон, який атом віддає дуже легко. Всі чотири орбіта лі й один електрон останнього рівня атоми натрію у кристалі металу надають для утворення хімічного зв’язку. Виходить, що в кристалі натрію електронів більше значно менше, ніж орбіталей. Це дозволяє електронам у металі вільно переміщуватись, переходячи з однієї орбіта лі на іншу. Такі рухливі електрони називаються усуспільненими або електронним газом. Тому метал можна подати як структуру, що складається з атомів металу, розміщених у вузлах кристалічної гратки, які утримуються за рахунок усуспільнених електронів.
Отже, металічний зв'язок зумовлений утворенням електронами усіх атомів речовини єдиної рухливої електронної хмари.
Металічний зв’язок є нелокалізованим, тобто таким, що не має певної напрямленості: у ньому беруть участь усі атоми кристалу металу.
Контрольні запитання:
- Що називається хімічним зв’язком? Назвіть його типи.
- Як впливає тип хімічного зв’язку на властивості речовин?
- Визначте тип хімічного зв’язку та поясніть механізм його утворення в таких речовинах: Cl2, MgCl2, NH3, N2, Na2O, O2, SO3.
- Передбачте властивості речовин за типом хімічного зв’язку: I2, H2S, MgO.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. ІV, §§ 39-47 с. 119-156.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 3, §§ 18-24, с. 27-34.
Тема 1.6. Міжмолекулярна взаємодія. Типи кристалічних ґраток.
- Міжмолекулярна взаємодія.*
- Вплив типу кристалічної ґратки на властивості речовин.**
1. Коли речовина перебуває в газоподібному стані, то частинки, що її утворюють, хаотично рухаються і при цьому переважну частину часу перебувають на великих відстанях одна від одної. Внаслідок цього сили взаємодії між ними дуже малі.
Коли речовина перебуває в конденсованому стані – рідкому чи твердому, відстані між частинками речовини малі і сили взаємодії між ними великі. Ці сили мають електричну природу. Але залежно від того, що являють собою частинки – чи вони є атоми металічного або неметалічного елемента, йони або молекули – ці сили істотно відмінні.
Якщо речовина побудована з атомів, але не є металом, то її атоми звичайно пов’язані один з одним ковалентним зв’язком. Якщо речовина має йонну будову, то йони, що її утворюють, утримуються один біля одного силами електростатичного притягання.
Для речовин з молекулярною структурою властива міжмолекулярна взаємодія.
Сили міжмолекулярної взаємодії (сили Ван-дер-Ваальса) слабші від ковалентних сил, але проявляються на більших відстанях. В їх основі лежить електростатична взаємодія диполів.
1) якщо речовина складається з полярних молекул (вода), то в конденсованому стані молекули орієнтуються одна відносно одної своїми різнойменно зарядженими кінцями, внаслідок чого спостерігається взаємне притягання їх (орієнтаційна взаємодія)
2) у речовин, що складаються з неполярних, але здатних до поляризації молекул (СО2) спостерігається виникнення наведених або індукованих диполів. Причина їх виникнення звичайно полягає в тому, що кожний атом створює поблизу себе електричне поле, яке викликає поляризуючи дію на найближчий атом сусідньої молекули. Молекула поляризується, і утворений індукований диполь, в свою чергу поляризує сусідні молекули. Внаслідок цього молекули притягуються одна до одної.
3) дисперсійна взаємодія: миттєві диполі виникають у твердих тілах і рідинах узгоджено, причому кінці сусідніх молекул виявляються зарядженими електрикою протилежного знака, що приводить до їх притягання.
2. Кристалічні гратки – розташування йонів, молекул, атомів у певному просторовому порядку.
Табл. Залежність властивостей від типу кристалічної гратки.
| Молекулярна | Атомна | Йонна | |
| Складові частки | молекули | атоми | йони |
| Тип зв’язку між частинками | міжмолекулярна взаємодія | ковалентний | йонний |
| Міцність | не досить тверді | тверді | тверді, ламкі |
| температури плавлення і кипіння | низькі | високі | високі |
| електропровідність | діелектрики | діелектрики або напівпровідники | діелектрики; у водних розчинах або розплавах - провідники |
| Розчинність у воді | розчинні (з полярним типом звязку) і нерозчинні (з неполярним типом зв’язку) | нерозчинні | розчинні |
| Приклади | вода, амоніак, сухий лід, сірка, йод (тв), фосфор, більшість орг. речовин | алмаз, графіт | більшість солей, оксидів і основ |
Контрольні запитання:
- Охарактеризуйте сили Ван дер Ваальса.
- Що називається кристалічною ґраткою? Назвіть типи кристалічних ґраток.
- Якими властивостями володіють речовини: вода, срібло, вуглекислий газ, графіт, кухонна сіль?
- Як розчиняються у воді речовини з різним типом кристалічної гратки?
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. V, §§ 48-51 с. 157-163.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 3, §§ 25-26, с. 34-36.
РОЗДІЛ 2. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ ПРОЦЕСІВ.
Тема 2.1. Реакції іонного обміну
- Поняття про реакції іонного обміну.*
- Умови перебігу реакцій іонного обміну:
2.1. Реакції з виділенням газу.*
2.2. Реакції з випаденням осаду.*
2.3. Реакції з утворенням слабкого електроліту*
1. Оскільки електроліти в розчинах розпадаються на йони, то і реакції електролітів повинні відбуватися між йонами.
Реакції йонного обміну – це реакції обміну в розчині за участю йонів.
Приклад: реакції між розчинами FeCl3 i KOH; Pb(NO3)2 i H2SO4
Для реакцій йонного обміну складають 3 рівняння реакцій: молекулярне, повне йонне і скорочене йонне.
Приклад:
1) записати рівняння реакції в молекулярному вигляді: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
2) переписати це рівняння, зобразивши речовини, що добре дисоціюють, у вигляді йонів, а ті, що виходять зі сфери реакції, - у вигляді молекул:
Fe3+ + 3Cl- + 3Na+ +3OH- → Fe(OH)3↓ + 3Na+ +3Cl-
Це йонне рівняння реакції.
3) виключити з обох частин йонного рівняння однакові іони, тобто іони, які не беруть участі в реакції (вони підкреслені): Fe3+ + 3Cl- + 3Na+ +3OH- → Fe(OH)3↓ + 3Na+ + 3Cl -
4) записати рівняння в скороченому вигляді: Fe3+ +3OH- → Fe(OH)3↓
2. Умови, за яких реакції йонного обміну від буваються в одному напрямку:
1) виділення газу;
2) випадення осаду;
3) утворення слабкого електроліту
2.1. Реакції з виділенням газу
Приклад:
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
2K+ + CO32- + 2H+ + SO42- → 2K+ + SO42- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
2.2. Реакції з утворенням осаду
Приклад:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl-
Ba2+ + SO42- → BaSO4↓
2.3. Реакції з утворенням слабкого електроліту (води)
Приклад:
2NaOH + H2SO4 → Na2SO4↓ + 2H2O
2Na+ + 2OH- + 2H+ + SO42- → 2Na++ SO42- + 2H2O
OH- + H+ → H2O
Контрольні запитання:
- Які реакції називаються реакціями йонного обміну?
- Умови проходження реакцій йонного обміну до кінця.
- Скласти рівняння йонного обміну в трьох формах між речовинами:
а) натрій силікат та хлоридна кислота;
б) натрій карбонатом та нітратною кислотою;
в) калій гідроксидом та сульфітною кислотою.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. VІІІ, § 88 с. 246-249.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 5, §44, 14, с. 52-53.
Тема 2.2. Окисно-відновні реакції
- Поняття про ступінь окиснення. Правила визначення ступенів окиснення.*
- Поняття про окисно-відновні реакції. *
- Типи окисно-відновних реакцій.*
- Метод електронного балансу.**
1. Ступінь окиснення – це умовний заряд атома в речовині за умови, що всі зв’язки іонні.
Ступінь окиснення складається з двох частин:
1) знаку (якщо + - атом віддав електрони; якщо – - атом приєднав електрони)
2) з числа (воно означає число електронів, зміщених від атома даного елемента до атома іншого елемента)
Правила для визначення С.О.:
1) С.О. атома елемента у вільному стані дорівнює 0.
2) С.О. Гідрогену дорівнює +1, а в гідридах металів дорівнює -1.
3) С.О. Оксигену дорівнює -2, тільки в OF2 дорівнює +2, в пероксидах -1.
4) С.О. усіх атомів в сполуці дорівнює 0.
5) С.О. усіх атомів в йоні дорівнює його заряду.
6) С.О. може бути дробним числом.
- Окисно-відновні реакції – це реакції, які відбуваються зі зміною ступеня окиснення елементів, що входять до складу реагуючих речовин.
Під час окисно-відновних реакцій одночасно відбувається 2 процеси – окиснення і відновлення.
Окиснення – процес віддачі електронів атомом, молекулою або йоном.
Відновлення – процес приєднання електронів атомом, молекулою або йоном.
Окисник – частинка, що приєднує електрони (неметали з високою електронегативнстю; катіони; йони та молекули, що місять елемент з високим с.о.)
Відновник – частинка, що віддає електрони (метали; аніони; неметали з невисокою електронегативність; йони та молекули, що містять атоми з невисоким (проміжним) с.о.)
3. Типи ОВР:
1) Міжмолекулярні (ступінь окиснення змінюють атоми, що входять до складу різних вихідних речовин)
0 +2 0 +1
Пр.: H2 + CuO → Cu + H2O
2) Внутрішньомолекулярні (атоми, що змінюють с.о., входять до складу однієї сполуки)
+1 -2 - 1 0
Пр.: 2KClO→ 2KCl + O2
3) Реакції диспропорціонування (атоми одного й того самого елемента з певним с.о. є як окисниками, так і відновниками)
+1 +2 0
Пр.: 2CuI→ CuI2 + Cu
4. Коефіцієнти в ОВР розставляються методом електронного балансу.
+5 -2 +4 0
Cu(NO3)2 → CuO + NO2 + O2
-2 0
2O – 4e → O2 1 відновник окиснюється
+5 +4
N + 1e → N 4 окисник відновлюється
Підставляємо знайдені коефіцієнти у схему реакції:
2Cu(NO3)2 → CuO + 4NO2 + O2
Підбираємо коефіцієнт перед формулою CuO:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Контрольні запитання:
- Що називається ступенем окиснення? Правила визначення ступенів окиснення.
- Визначте ступені окиснення в речовинах: K2Cr2O7, H2SO3, HClO, KClO3.
- Які реакції називаються окисно-відновними? Навести приклади.
- Розставте коефіцієнти методом електронного балансу, визначте тип окисно-відновних реакцій:
а) H2S + HNO3 → H2SO4 + NO2 + H2O
б) NH4NO2 → N2 + H2O
в) K2MnO4 + H2O → KMnO4 + MnO2 + KOH
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. IX, §§ 93-97 с. 264-272.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 3, § 28, Гл. 7, §§ 55-59, с. 37-38, 66-74.
Тема 2.3. Енергетика хімічних реакцій
- Термохімія. Поняття про тепловий ефект реакцій.
- Класифікація реакцій за тепловим ефектом. Термохімічні рівняння.*
- Закон Гесса.*
1. Хімічні реакції супроводжуються певними енергетичними змінами. Ці енергетичні зміни іноді навіть важливіші, ніж утворення в процесі цих реакцій нових речовин. Як приклад досить згадати реакції горіння палива. Тому важливо вивчати ті енергетичні зміни, які відбуваються під час реакцій.
Розділ хімії, присвячений кількісному вивченню теплових ефектів реакцій, називається термохімією.
Хімічні реакції відбуваються з виділенням або поглинанням енергії. Звичайно ця енергія виділяється або поглинається у вигляді теплоти. Виділення теплоти при взаємодії різних речовин дає підставу визначати, що ці речовини ще до реакції в прихованій формі мали певну енергію. Така форма енергії, яка прихована в речовинах і яка вивільняється під час хімічних, а також деяких фізичних процесів називається внутрішньою енергією речовини.
Під час хімічних перетворень вивільняється частина енергії, яка є в речовинах. Вимірюючи кількість теплоти, що виділяється під час реакції, можемо судити про зміну цього запасу. Тепловий ефект реакції – це теплота, яка виділяється (поглинається) під час реакції.
Тепловий ефект залежить від: природи реагуючих речовин, маси реагуючих речовин, температури, агрегатних станів речовин, алотропних модифікацій.
2. За тепловим ефектом всі реакції поділяються на екзотермічні і ендотермічні. Реакції, що відбуваються з виділенням енергії, називають екзотермічними, а реакції, під час яких енергія поглинається – ендотермічними.
Теплові ефекти можна включати в рівняння реакцій. Хімічні рівняння, в яких вказано тепловий ефект реакції називаються термохімічними рівняннями. Величину теплового ефекту звичайно записують у правій частині рівняння із знаком плюс у випадку екзотермічної реакції і з знаком мінус у випадку ендотермічної реакції.
Пр.: 2H2 + O2 → 2H2O + 571,6 кДж
N2 + O2 → 2NO – 90,25 кДж
Теплові ефекти реакцій прийнято відносити до 1 моля речовини, що утворюється. Кількість теплоти, яка виділяється або поглинається під час утворення 1 моля сполуки з простих речовин, називається теплотою утворення даної сполуки.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 513; Нарушение авторских прав?; Мы поможем в написании вашей работы!