
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Та молекулярної фізики 4 страница
 |
4. При усталеній температурі вологого термометра записати показання обох термометрів з точністю до 0,1˚С.
5. За таблицею пружності насиченої пари визначити тиск насиченої пари PH/ при температурі Тв.
6. Обчислити абсолютну вологість за формулою (4), підставляючи атмосферний тиск H за показанням барометра та приймаючи А=0,0005 К-1.
7. Обчислити відносну вологість за формулою (1), для чого з таблиці тиску насиченої пари знайти тиск PH, що відповідає температурі сухого термометра Тc.
8. Користуючись номограмою або психрометричною таблицею, знайти відносну вологість B/ за показаннями Тc та Тв.
Результати вимірювань та розрахунків подати в таблиці:
| Тc | Тв | A | H | PH/ | P | PH | B | B/ |
Дайте відповіді на запитання:
1.Що таке абсолютна та відносна вологість? Якими одиницями вони можуть бути виміряні?
2.Чому роса випадає вночі та вранці?
3. Що треба зробити, щоб підвищити або знизити відносну вологість в приміщенні?
Лабораторна робота № 16.
Дослідження теплопровідності твердих тіл.
Прилади та приладдя: прилад Христиансена, комплект термопар з перемикачем, гальванометр, пароутворювач, набір дисків з гуми, ебоніту та досліджуваних матеріалів, лійка і склянка для заливання води в пароутворювач.
Мета роботи: засвоїти один із методів визначення коефіцієнта теплопровідності.
Коротка теорія та метод вимірювань
Теплопровідність - це явище, пов’язане з переносом тепла від більш до менш нагрітого тіла при контактуванні тіл або більш нагрітої частини одного тіла до менш нагрітої.
При виникненні різниці температур спочатку йде процес так званої нерівноважної теплопровідності, при який температура в будь-який точці з плином часу змінюється. Проте, якщо між будь-якими частинами тіла підтримувати незмінну різницю температур, то нерівноважна теплопровідність з часом перейде в рівноважну, коли по всьому тілу встановиться незмінний з часом розподіл температур. При цьому за проміжок часу t через будь-який переріз S в тілі переноситься кількість тепла Q, яка визначається законом Фур’є:
|
|
|
Q = - k 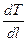 S t, (1)
S t, (1)
де k - коефіцієнт теплопровідності данного тіла, що визначається його фізичною природою; dT/dl – градієнт температури. Градієнт даної фізичної величини – це похідна по напрямку найбільшого її росту; при сталості похідної по даному напрямку градієнт можна визначити як зміну фізичної величини, віднесену до одиниці довжини по даному напрямку.
Наявність знака “мінус” в (1) вказує, що перенос тепла відбувається за напрямком зменшення температури, де dT/dl<0. Смисл коефіцієнта теплопровідності k стане зрозумілим, коли в (1) покласти dT/dl =1 К/м, S = 1м2, Δt = 1с. Тоді коефіцієнт теплопровідності чисельно буде дорівнювати кількості тепла, що переноситься через площу 1 м за 1 с при градієнті температури 1 К/м. Чим більший коефіцієнт теплопровідності k, тим краще тіло проводить тепло. Високу теплопровідність мають метали, меншу - діелектрики, найменшу - гази.
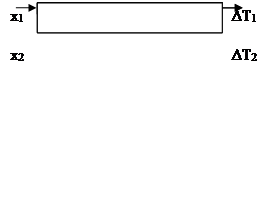 |  | ||
Складемо установку у такий спосіб: нижня камера - холодильна, тонкий шар м’якої гуми, еталонне тіло, знову тонкий шар м’якої гуми, нагрівальна камера.
Для забезпечення добрих теплових контактів проміжні пластини виготовляють з м’якої гуми. Різницю температур між поверхнями досліджуваних тіл вимірюють диференціальними термопарами.
Пропустимо через нижню камеру водопровідну воду, а через верхню - пару з кип’ятильника. Якщо різниці температур ΔT1 і ΔT2 не змінюються, то це значить, що встановився за часом розподіл температур, і процес переносу тепла можна описувати співвідношенням (1).
|
|
|
Потурбуймося про те, щоб розміри пластин були набагато більші за їх товщину. Це необхідно для того, щоб можна було вважати, що тепловий потік не відводиться через бокові зрізи пластин, а проходить перпендикулярно до пластин.
Оскільки товщини еталонної пластини х1 і досліджуваної х2 малі, то градієнти температури в пластинах можна замінити відношеннями ΔT1 / х1 і ΔT2 / х2, де ΔT1 - різниця температур між протилежними поверхнями еталонної пластини, ΔT2 - те ж саме для досліджуваної.
Застосуємо співвідношення (1) для кількості тепла, що пройшло через еталонну і досліджувану пластини:
ΔQ1 = - k1 (ΔT1 / х1 ) S Δt (2)
ΔQ2 = - k2 (ΔT2 / х2 ) S Δt. (3)
В співвідношеннях (2) і (3) площі пластин та проміжки часу однакові.
Кількості тепла ΔQ1 і ΔQ2 однакові, тому що втратами тепла із-за відводу його через бокові зрізи ми нехтуємо. Прирівнюючи (2) і (3), знайдемо невідомий коефіцієнт теплопровідності k2:
k2 = k1 (ΔT1 / х1 ) / (ΔT2 / х2 ). (4)
В роботі показання термопар пропорційні різницям температур, тому відношення градієнтів температур в (4) можна замінити відношенням градієнтів показань гальванометра:
k2 = k1 (І1 / х1 ) / (І2 / х2 ). (5)
де І1 - показання гальванометра при приєднанні термопари до еталонної, а І2 - до досліджуваної пластини.
Порядок виконання роботи:
1. Ознайомитися з установкою. Відгвинтити впускний отвір і наповнити пароутворювач водою за допомогою склянки і лійки. Перевірити нульове положення стрілки гальванометра.
2. Підготувати установку до вимірів: вкласти на нижню камеру гумовий диск, один спай термопари 1, еталонний диск, другий спай термопари 1, гумовій диск, перший спай термопари 2, досліджуваний диск, другий спай термопари 2, гумовий диск, нагрівальну камеру. Скріпити весь стос затискним гвинтом.
3. Злегка відгвинтити кран і пропустити через нижню камеру струмінь водопровідної води. Ввімкнути до мережі штепсель пароутворювача.
4. Дочекатись кипіння, потім ще почекати 3-5 хвилин, послідовно перемкнути термопари і записати показання гальванометра. Якщо показання гальванометра на термопарах не змінюються, то записують його показання І1 на “еталонній” термопарі і І2 - на термопарі, приєднаній до досліджуваного тіла.
|
|
|
5. Вимкнути пароутворювач, закрити водопровідний кран, розібрати стос дисків, виміряти товщину кожного в трьох місцях. Знайти середнє значення товщини кожного диска.
Виконати за формулою (5) розрахунки, приймаючи для ебоніту k1=0,175 Вт/(м·К).
Результати вимірювань та обчислень дати в таблиці:
| k1 | х1 | J1 | J2 | х2 | k2 |
Дайте відповіді на запитання:
1. Який основний закон покладено в основу роботи?
2. Чому в даному методі вимірювань діаметри пластин мають бути значно більшими за їх товщину?
3. Чому нагрівальна камера знаходиться зверху?
Лабораторна робота № 17.
Дослідження властивостей газів методом витікання їх через капіляр.
Прилади та приладдя: експериментальна установка, що складається з балона з капіляром та краником, водяного манометра та насоса з краном, секундомір, барометр, термометр.
Мета роботи: засвоїти один із методів визначення параметрів теплового хаотичного руху молекул в газах.
Коротка теорія і метод вимірювання
В роботі визначаються деякі параметри, що характеризують тепловий хаотичний рух молекул газів, за допомогою співвідношень молекулярно-кінетичної теорії. За основний приймається метод, що основується на вимірюванні коефіцієнта внутрішнього тертя (в’язкості) газу при його витіканні через трубку кругового перетину – капіляр.
В усталеному потоці маса газу, що переноситься через елемент поверхні dS за час t, може бути знайдена як добуток густини газу ρ на об’єм газу V, що перенесений через перетин площею S із швидкістю v:
dm = ρ dV = ρv t dS. (1)
В зв’язку з наявністю внутрішнього тертя швидкість газу v в різних точках перетину капіляра різна: вона максимальна на осі капіляра і дорівнює нулю біля його стінок. Пуазейль отримав формулу для розподілу швидкостей газу або рідини в трубці радіусу r на різних відстанях rx від осі в залежності від різниці тиску P/- P на кінцях трубки довжиною l:
v = 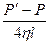 (r2 - rx2), (2)
(r2 - rx2), (2)
де η - коефіцієнт внутрішнього тертя газу.
Якщо об’єм посудини, в якій знаходиться газ, і температура газу сталі, то величину η можна пов’язати зі зміною тиску газу в посудині. Дійсно, із рівняння Менделєєва-Клапейрона знаходимо, що
|
|
|
dm = 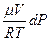 , (3)
, (3)
де μ - молярна маса газу; R- універсальна газова стала; T - температура газу; dP - зміна тиску в посудині, пов’язана з витіканням з неї газу.
Прирівнюючи (1) і (2), а також виконуючи інтегрування одержаного виразу, можна записати вираз для коефіцієнта в’язкості газу:
η = 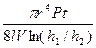 , (4)
, (4)
тут V - об’єм балона; l - довжина капіляра; h1і h2 - початковий і кінцевий надлишкові тиски газу в балоні, відлічені на манометрі як різниця рівнів; P - атмосферний тиск (в паскалях); T - температура газу; t - час витікання газу. Надлишковий тиск газу має бути малим порівняно з атмосферним тиском.
Кінетична теорія ідеального газу дає зв’язок коефіцієнта в’язкості η з густиною ρ газу, середньою довжиною вільного пробігу молекул λ:
η = ρ λ u / 3. (5)
Знаходячи густину газу із рівняння Менделєєва-Клапейрона і підставляючи в (5) значення u = 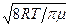 , можна знайти величину середньої довжини вільного пробігу молекул:
, можна знайти величину середньої довжини вільного пробігу молекул:
λ = 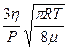 . (6)
. (6)
Кінетична теорія газів встановлює залежність середньої довжини вільного пробігу молекул від ефективного діаметра молекул d і числа молекул в одиниці об’єму n:
λ = 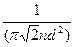 (7)
(7)
де n = P /(kT); k - стала Больцмана.
У такий спосіб за відомою λ можна знайти ефективний діаметр молекул. Підставляючи n в (7), одержуємо
d = 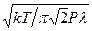 . (8)
. (8)
Порядок виконання роботи:
1. Ознайомитися з установкою, визначити всі необхідні для розрахунків параметри і занести їх до таблиці.
2. Відкрити кран насоса і закрити кран капіляра. Накачати насосом повітря в балон, так щоб різниця рівнів досягала 25-40 см. Закрити кран насоса.
3. Через 3-5 хв., коли температура повітря в балоні зрівняється з температурою навколишнього середовища і не буде змінюватись рівень води в манометрі, зробити відлік різниці рівнів h1 в манометрі з точністю до 1 мм.
4. Відкрити краник капіляра, одночасно включити секундомір і виміряти час t опускання надлишкового тиску до 8-12 см водяного стовпа.
5. Записати атмосферний тиск і температуру повітря.
6. Вимірювання за пунктами 2-5 провести тричі для однакових h1 і h2.
Користуючись відповідними співвідношеннями, обчислити коефіцієнт внутрішнього тертя η, середню довжину вільного пробігу молекул λ і газокінетичний діаметр молекул повітря d; молярна маса повітря дорівнює 0,029 кг/моль.
Результати вимірів та розрахунків подати в таблиці:
| № | r | l | V | P | T | h1 | h2 | t | η | λ | d |
| Середні значення |
Дайте відповідь на запитання:
1. Який фізичний смисл коефіцієнта внутрішнього тертя?
2. Як має змінюватись в’язкість газів в залежності від температури?
3. Що таке середня довжина вільного пробігу молекул і від чого вона залежить?
4. Як залежить середня довжина вільного пробігу молекул від тиску при сталій температурі?
Лабораторна робота № 18.
Визначення універсальної газової сталої акустичним методом.
Прилади і приладдя: труба з рухомим поршнем, гумовий молоточок, масштабна лінійка, термометр.
Мета роботи: засвоїти акустичний метод дослідження газів.
Коротка теорія
Звукові коливання, поширюючись в повітрі, являють собою періодично повторювані розрідження та згущення повітря. Якщо частота коливань висока, то, внаслідок малої теплопровідності повітря, не встигає відбуватися теплообмін між місцями згущень і розріджень. Процес поширення звуку в повітрі можна вважати адіабатичним, тобто таким, що відбувається без теплообміну. На цій основі одержано такий вираз для швидкості поширення звуку в газах:
v = 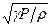 , (1)
, (1)
де γ=Cp/Cv - показник адіабати, що дорівнює відношенню молярних теплоємностей при ізобаричному Cp і ізохоричному Cv процесах, P і ρ - тиск і  густина газу.
густина газу.
Відношення P / ρ можна визначити з рівняння Менделеєва-Клапейрона:
PV = 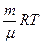 . (2)
. (2) 
Підставляючи (2) в (1) і визначаючи швидкість звуку як v = 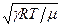 , визначимо із останнього універсальну газову сталу:
, визначимо із останнього універсальну газову сталу:
R = 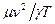 . (3)
. (3)
Показник адіабати γ виразимо через ступенів вільності молекул газу і:
γ = Cp/Cv = (і +2)/і. Підставивши його значення в (3), одержуємо
R = μ i v2 / (і + 2) T. (4)
Швидкість звуку можна виразити через довжину хвилі λ і частоту коливань ν.
v = λν. (5)
Тому остаточно з (4) одержуємо
R = μ i λ2 v2 / (і + 2)T. (6)
Порядок виконання роботи:
1. Повільно рухаючи поршень від обрізу труби, безперервно постукуючи молоточком по камертону, при різкому підсиленні звуку підібрати положення поршня, що відповідає найбільшій гучності звуку. Виміряти відстань l1 від обрізу труби до поршня.
2. Продовжуючи рух поршня, найдіть інше положення l2 резонансного звучання.
3. Виконати дії за пунктами 1-2 тричі і обчислити середні значення l1і l2.
4. Визначити за середніми l1і l2 довжину хвилі згідно роботи № 13:
λ = 2 (l2 - l1).
5. Для молекул повітря прийняти число ступенів вільності і=5, молярну масу
μ = 0,029 кг/моль. Обчислити за (6) універсальну газову сталу.
Результати вимірювань та розрахунків занести до таблиці:
| ν | l1 | L2 | λ | T | I | μ | R |
Дайте відповідь на запитання:
1. Який процес називається адіабатичним?
2. Чому процес розповсюдження звуку можна розглядати як адіабатичний?
3. Як впливає на результат наявність вологи в повітрі, якщо прийняти для молекул води і=6?
Лабораторна робота № 19.
Дослідження зміни ентропії в реальних процесах.
Прилади та приладдя: пароутворювач, нагрівач, калориметр, два термометри, два досліджуваних твердих тіла (мідне та алюмінієве), технічні терези, різноваги.
Мета роботи: засвоїти поняття однієї з важливих характеристик системи – ентропії.
Коротка теорія та метод вимірювання
Будь-який реальний процес переходу системи з одного стану в інший протікає у такий спосіб, що неможливо його провести в зворотному напрямку без змін в навколишніх тілах. Це пов’язано з розсіянням частини енергії, з наявністю тертя, теплопередачі, випромінювання та інших причин. Реальні процеси в природі незворотні. В будь-якому з них змінюється стан системи, частина енергії розсіюється. Для характеристики цієї загальної для всіх систем властивості і вводять фізичну величину – ентропію, яка служить мірою безповоротного розсіяння тепла. Це виявляється надто важливим, тому що багато процесів в природі протікають за участю тепла. Поняття зміни ентропії вводиться як відношення елементарної теплоти процесу dQ до температури Т, при якій відбувається цей безмежно малий процес:
dS = dQ / T. (1)
Зміна ентропії в кінцевому процесі знаходиться як інтеграл від (1):
ΔS = ∫ (dQ / T). (2)
Запишемо перше начало термодінамики
dQ = dW + dA, (3)
де dQ - теплота, отримана системою; dW - зміна внутрішньої енергії системи; dA - робота, виконувана системою проти зовнішніх сил. Підставляючи в (3) із (1) dQ = T dS, отримаємо
T dS = dW + dA. (4)
Розглянемо ще одну з характеристик системи - вільну енергію, яка визначається так:
F = W – T S. (5)
Знайдемо диференціал від (5) і підставимо в нього значення dW:
dF = - S dT + dA. (6)
Із (6) для ізотермічного процесу (dT = 0) випливає важливий висновок: робота, виконувана системою в ізотермічному процесі, дорівнює зміни вільної енергії системи. В ізотермічному процесі вся вільна енергія системи може бути використана для виконання роботи. Що ж стосується внутрішньої енергії системи, то із (5) випливає, що не вся внутрішня енергія системи в ізотермічному процесі може бути використана для виконання роботи, а тільки частина її за виключенням TS. За рахунок так званої зв’язаної енергії TS в ізотермічному процесі неможливо виконати роботу. В ізотермічному процесі ентропія виступає таким чином, як міра безкорисності частини внутрішньої енергії системи з точки зору виконання роботи.
В даній роботі розглядається система з двох тіл, нагрітий шматок металу при температурі T1 і вода в калориметрі при температурі T2. Визначимо зміну ентропій цих тіл при зміні температури металу на dT.
Нехай маси та питомі теплоємкості відповідно у тіл системи такі: m, c - у метала; m1, c1- у води; m2, c2 - у калориметра. При зміні температури на dT метал віддає воді і калориметру кількість тепла dQ = mcdT, а вода і калориметр одержують кількість тепла dQ/ = (m1 c1 + m2 c2 ) dT/. Елементарна зміна ентропії тіла dS = dQ / T = m c dT / T, води і калориметра dS/ = dQ/ / T/ = (m1c1 + m2 c2) dT//T‘, причому у виразах для dS і dS/ використовуються значення температур відповідних тіл, при яких відбувається теплообмін у кожного тіла окремо.
Загальна зміна ентропії дорівнює, згідно з (2):
ΔS = ∫ m c dT / T + ∫ (m1 c1 + m2 c2 ) dT/ / dT/, (7)
де інтегрування легко провести, якщо вважати, що при теплообміні не відбувається зміни мас і питомих теплоємкостей тіл. В цьому випадку з під інтегралу можна винести відповідні множники, і після чого одержати
S = m c ∫dT / T + (m1 c1 + m2 c2 ) ∫dT// dT/. (8)
Інтегрування в кожному доданку правої частини (8) проводиться у власних межах зміни температури: інтегрування в першому доданку проводиться від початкової температури металу T1 до рівноважної T0, а інтегрування в другому – від почaткової температури води та калориметра T2 до рівноважної T0. Звичайно, можливими втратами системою теплоти будемо нехтувати. Табличний інтеграл dx/x = d (ln x), тому з (8) одержуємо остаточний вираз
ΔS = m c ln(T0 / T1) + (m1 c1 + m2 c2 ) ln(T0 / T2), (9)
за яким підраховується зміна ентропії при теплообміні нагрітого металу з водою і калориметром.
Порядок виконання роботи:
Завдання 1.
1. Налити воду в пароутворювач і ввімкнути його в мережу.
2. На технічних терезах визначити масу мідного тіла з точністю до 1 г.
3. Ввести тіло в нагрівач і зачинити його. Через отвір в кришці нагрівача вставити термометр.
4. Зважити калориметр і знайти m2.
5. Налити в калориметр води приблизно до ½ висоти і знову зважити його. Різниця між масою калориметра з водою і масою пустого калориметра дає масу води m1.
6. Коли температура в нагрівачі досягне 60-70 ˚С, визначити температуру води в калориметрі Т2, нагрітого тіла T1 в нагрівачі і швидко опустити нагріте тіло в калориметр з водою.
7. Повертаючи калориметр з підставкою з боку на бік і перемішуючи тим самим воду, домогтися встановлення рівноважної температури T0.
8. За даними експерименту визначити зміну ентропії ΔS системи за формулою (9), приймаючи табличні значення питомих теплоємностей.
Результати подати в таблицю:
| Тіло | m | m1 | m2 | c | c1 | c2 | T1 | T2 | T0 | ΔS |
Завдання 2.
Зробити все, що вказано в завданні 1, для алюмінієвого тіла.
Дайте відповідь на запитання:
1. Збільшується чи зменшується ентропія у вивчених процесах?
2. Чому зміни ентропії для випадків нагрітих мідного і алюмінієвого тіл виявляються різними?
Лабораторна робота № 20.
Дослідження поверхневого натягу води.
Прилади та приладдя: вимірювальна установка, металеве кільце, штангенциркуль, різноваги, чашка Петрі, дистильована вода, розчини мила, цукру та кухонної солі.
Мета роботи: засвоїти один з методів вимірювання коефіцієнта поверхневого натягу рідини.
Коротка теорія та метод вимірювання
В поверхневому шарі будь-якої рідини товщиною близько 10–9 м діють незрівноважені сили молекулярного тиску, які призводять до появи сил поверхневого натягу. Сили молекулярного тиску в поверхневому шарі спрямовані перпендикулярно до поверхні рідини і стискують нижче розташовані шари. Поверхневий шар є своєрідною плівкою, що обтягує рідину і стискує її.
Для того, щоб розірвати поверхневу плівку рідини, потрібна деяка сила, спрямована по дотичній до поверхні рідини. Для характеристики індивідуальних властивостей різних рідин вводиться фізична величина (коефіцієнт поверхневого нааатягу), що чисельно дорівнює силі поверхневого натягу, діючій по дотичній до поверхні рідини, яка припадає на одиницю довжини контура, перпендикулярного до напрямку дії сили. Коефіцієнт поверхневого натягу (α) дорівнює:
α = F / l. (1)
Щоб довести, що α є індивідуальною характеристикою рідини, розглянемо детальніше стан молекул в поверхневому шарі рідини.
На відміну від молекул, що знаходяться всередині об’єму рідини, на молекули поверхневого шару діють сили з боку молекул, що наповнюють напівпростір з боку рідини. Рівнодіюча окремих сил спрямована по нормалі всередину рідини і втягує молекули поверхневого шару в об’єм рідини. На місце молекул, що залишили поверхню рідини, із об’єму рідини надходять інші молекули, але такі, енергія котрих в середньому більша за середню енергію молекул всієї рідини. Отже, поверхневий шар рідини формується з молекул, повна енергія яких більша, ніж у молекул в об’ємі рідини. Поверхневий шар рідини має надлишкову енергію в порівнянні з будь якими молекулами, виділеними в рідині.
При збільшенні поверхні рідини на ΔS її надлишкова поверхнева енергія підвищується на деяку величину ΔW, тому на збільшення поверхні на одну одиницю потрібна питома надлишкова поверхнева енергія
w = ΔW / ΔS. (2)
 | |||
 | |||
Якщо переміщення вздовж напрямку дії сили дорівнює Δx, то сила виконує роботу, яка дорівнює добуткові величини F на Δx: A = F Δx. Силу F визначимо, згідно з (1), як α l, де l - довжина рухомої боковиці каркасу. Тоді виконана робота може бути подана як
A = α l Δx. (3)
Ця робота пішла на збільшення надлишкової поверхневої енергії рідини, яку, згідно з (2), можна подати як W = w ΔS. Прирівнюючи останнє значення виразу з (3), одержимо
α l Δx = w ΔS,
звідки знаходимо
α = w ΔS / (l Δx) = w. (4)
тому що lΔx саме і є величина збільшення поверхні ΔS. Отже, коефіцієнт поверхневого натягу рідини чисельно дорівнює питомій поверхневій надлишковій енергії рідини. Енергетичні характеристики індивідуальні, вони залежить від складу рідини. Так, чиста вода має при кімнатній температурі коефіцієнт поверхневого натягу майже 0,07 Н/м. Добавка до води жирних кислот або мила значно знижує коефіцієнт поверхневого натягу. Такі домішки називають поверхнево активними речовинами.
Як зазначалось, силу поверхневого натягу можна виміряти, розриваючи поверхневий шар рідини. В даній роботі застосовується відрив кільця від змочуючої його рідини. При підйомі кільця з рідини разом з ним підіймається частина рідини. Якщо знехтувати вагою цієї рідини, то основне зусилля визначається силами поверхневого натягу. Згідно з рис. 2, сила поверхневого натягу, діюча на зовнішню поверхню кільця у відповідності з (1), дорівнює:
F = α l = α [π D + π (D – 2b) ] = 2 α π (D – b),
де b - товщина стінки кільця; D - зовнішній діаметр кільця.
За виміряною силою з останнього співвідношення знаходимо коефіцієнт поверхневого натягу:
 | |||
 | |||
α = F / 2π (D - b) (5)
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 281; Нарушение авторских прав?; Мы поможем в написании вашей работы!