
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. 1. Маса молекули деякої речовини становить 1,2×10-25 кг
|
|
|
|
Задачі
1. Маса молекули деякої речовини становить 1,2×10-25 к г. Чому дорівнюють відносна молекулярна та молярна маси цієї речовини? Яку кількість містить 1 к г цієї речовини?
2. Маса 1×10-3 м3 газу (н.у.) дорівнює 1,175×10-3 к г. Розрахуйте молекулярну масу газу і масу однієї його молекули. Яке число молекул газу знаходиться у даному об’ємі?
3. Чому дорівнюють молекулярна, молярна маси та маса однієї молекули СО2? Який об’єм СО2 (н.у.) утвориться при згорянні 1,2×10-2 к г вуглецю? Яке число молекул цього газу буде знаходитись у цьому об’ємі?
4. Порівняйте число молекул, які містяться у 4 к г кожного з газів: СО2 і NO2. Визначте кількості цих речовин і об’єми, що займають гази за н.у.
5. Маса 8,7×10-5 м3 газу при 62 °С і тиску 1,01×105 Па дорівнює 2,4×10-4 к г. Розрахуйте молекулярну масу речовини і масу однієї його молекули.
6. Які об’єм і маса оксиду нітрогену (II) утворюються при взаємодії 5×1020 молекул азоту з киснем? Чому дорівнюють молекулярна і молярна маси, маса однієї молекули NO?
7. Яка кількість речовини і скільки молекул містяться: а) 0,1 м3 водню (н.у.); б) 0,1 к г водню? Чому дорівнює маса однієї молекули Н2?
8. В якій масі СО2 міститься стільки ж молекул, скільки їх у 2,8×10-3 к г СО? Які кількості речовин містяться у цих масах?
9. При розпіканні СаСО3 масою 1 к г одержані СаО масою 0,56 к г і СО2 об’ємом 0,224 м3 (н.у.). Чи підтверджують ці дані закон збереження маси речовин? Визначте число молекул і кількість речовини СО2 у наведеному об’ємі?
10.Чому дорівнюють молярна маса та маса однієї молекули метану (СН4)? Складіть рівняння реакції горіння метану на повітрі і розрахуйте об’єм і масу цього газу, якщо на його згоряння витрачено 112 л кисню.
11.Визначте масову частку домішок (%) у технічному цинку, якщо його наважка масою 20,4 г витісняє з соляної кислоти, взятої у надлишку, водень об’ємом 6,272 л (н.у.)? Яку кількість речовини становить указаний об’єм водню? Скільки молекул газу містяться у ньому?
|
|
|
12.Змішано рівні за масою (10 г) кількості газів: водню Н2, метану СН4 і азоту N2. Розрахуйте об’єм (н.у.) газової суміші, масу одного її літру (н.у.), загальне число молекул усіх газів у 1 л суміші.
13.Для газоподібних азоту N2 і оксиду карбону (II) CО визначити: а) співвідношення об’ємів рівних мас цих газів; б) маси 1 л газів; в) молярні маси і маси однієї молекули кожного з цих газів.
14. Маси 1 л наведених газів дорівнюють: а) ацетиленy - 1,17 г; б) гелію - 0,17 г; в) етану - 1,36 г. Визначте молекулярні, молярні маси і маси однієї молекули кожного газу. Використовуючи величину відносної густини одного газу за іншим, визначте, який газ важчий, а який - легший за повітря?
15.У три склянки з водою опущено по 1 граму металів: у першу - натрію, у другу - калію, у третю - кальцію. В якому випадку виділиться найбільша кількість водню? Розрахуйте кількість, масу та об’єм водню у цій реакції. Чому дорівнює маса однієї молекули Н2?
16.Розрахуйте об’ємну частку оксиду карбону (II) СО у газовій суміші складу 3СО + 5N2 + 2СО2? Яка густина цієї суміші за повітрям?
17.Визначте масу 1 л газової суміші складу (н.у.): СО + 2N2 (генераторний газ). Яка кількість молів і яке число молекул кожного газу знаходяться у цьому об’ємі?
18.Дана газова суміш складу 3СО + 7СО2. Розрахуйте: а) середню молекулярну масу суміші; б) масу 1 л суміші (за н.у.); в) густину суміші за воднем; г) масу 10 л суміші (н.у.); д) об’єм 1 к г суміші (н.у.).
19.Газоподібна речовина масою 0,08 г займає об’єм 11,2 мл за н.у. Розрахуйте молярну, молекулярну маси та масу однієї молекули цього газу. Яка кількість молів речовини і яке число молекул знаходяться у цій масі газу?
20.Яка і в якому об’ємі (н.у.) знаходиться кількість молекулярного азоту (моль), якщо вона містить 1,2 × 1022 молекул? Розрахуйте масу цієї кількості газу.
|
|
|
21.В ємності змішано гази: СО2, О2 і N2, маси яких відповідно становлять 11, 16 і 21 г. В яких об’ємних співвідношеннях змішано ці гази? Розрахуйте середню молекулярну масу цієї газової суміші та її густину за киснем.
22.При згорянні аміаку в кисні у присутності платинового каталізатора утворюються газоподібний оксид нітрогену (II) NO і водяний пар. У яких об’ємних і масових співвідношеннях реагують аміак і кисень? Розрахуйте кількість, масу та об’єм (н.у.) NO, який утворився, якщо прореагувало 10 л (н.у.) NH3.
23.Відносна густина газу за воднем становить 8,5. Чому дорівнює молекулярна, молярна маси цього газу, маса однієї його молекули? Визначте кількість речовини (моль) і об’єм (н.у.), який займає 1,7 к г газу.
24.Двохвалентний метал масою 2 г витісняє з розчину хлоридної кислоти 1,12 л (н.у.) водню. Визначте, який це метал. Чому дорівнює маса водню, який утворився, скільки його молекул містяться у цьому об’ємі?
25.Маса молекули деякої речовини дорівнює 2×10-22 г. Чому дорівнюють молекулярна та молярна маси цієї речовини? Скільки молекул містяться у 10 г речовини? Яку кількість молів це складає?
2. БУДОВА АТОМІВ. ПЕРІОДИЧНИЙ ЗАКОН ТА ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
Наслідком квантово-механічного підходу до будови атомів хімічних елементів є теорія так званих квантових чисел, підстановка яких у певні формули дає можливість розрахувати енергію електрона та геометричну форму атомної орбіталі, тобто форму тої області простору навколо ядра, де ймовірність перебування електрона максимальна. Стан електрона в атомі повністю характеризується чотирма квантовими числами, і при цьому, згідно з принципом Паулі, не може існувати навіть двох електронів з однаковими наборами цих чисел. Це означає, що на одній атомній орбіталі (АО) можуть знаходитись максимум два електрони, причому тільки з протилежними значеннями спінового квантового числа.
Приклад 1. Наведіть значення 4-х квантових чисел для чотирьох електронів 4 р -підрівня.
Розв’язання. Оскільки всі електрони знаходяться на 4-му рівні та р -підрівні, для них головне квантове число n = 4 і орбітальне (побічне) квантове число l = 1. Пам’ятаємо, що р -підрівень складається з трьох орбіталей, тому що при значенні l = 1 магнітне квантове число ml = {-1; 0; +1} – три значення. Отже, три перші електрони розташовуємо, згідно з правилом Гунда, по одному в комірку з однаковими значеннями спінового квантового числа ms = +½, а четвертий - у комірку з протилежним значенням ms = -½. Відповідь подаємо у вигляді таблиці:
|
|
|
| Електрони | n | l | ml | ms |
| -1 | ½ | |||
| ½ | ||||
| +1 | ½ | |||
| -1 | -½ |
Електрони розташовуються за енергетичними рівнями та підрівнями згідно з принципом найменшої енергії. При цьому потрібно знати правила Клечковського: чим менша сума головного та орбітального квантових чисел підрівня, тим меншу енергію він має, а при однакових сумах цих чисел для певних підрівнів меншу енергію має підрівень з меншим значенням головного квантового числа. Отже, можна записати таку послідовність енергетичних рівнів і підрівнів:
1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s ….
При написанні електронних формул (конфігурацій) хімічних елементів треба пам’ятати, що кількість електронів у атомі дорівнює порядковому номеру елемента у таблиці Д.І. Менделєєва. Загальну інформацію про знаходження елемента у таблиці, його характеристику та властивості його сполук дають валентні електрони, до яких відносяться всі електрони зовнішнього (останнього) рівня (шару) та електрони передостаннього рівня, але тільки того підрівня, що не заповнений електронами до кінця.
Розглянемо, наприклад, електронні формули Титану (№22) і Стануму (№50):
22Ti: 1 s  2 s
2 s  2 p
2 p  3 s
3 s  3 p
3 p  3 d
3 d  4 s
4 s  ;
;
50Sn: 1 s  2 s
2 s  2 p
2 p  3 s
3 s  3 p
3 p  3 d
3 d  4 s
4 s  4 p
4 p  4 d
4 d  5 s
5 s  5 p
5 p  .
.
У Титану валентні електрони 3 d 2 4 s 2, у Стануму - 5 s 2 5 p 2. Далі електронна формула має бути проаналізована у такому порядку:
1. Період елемента у таблицівизначається за числом енергетичних рівнів, на яких знаходяться електрони: 4 - у Титану, 5 - у Стануму.
2. Група елемента у таблиці визначається загальною кількістю валентних електронів: IV група в обох елементів, тому що d 2 + s 2 Þ 4 e, s 2 + p 2 Þ 4 e (тобто чотири електрони).
|
|
|
3. Електронна родина – назва підрівня, що заповнюється електронами в останню чергу: d 2 - d- родина у Титану, p 2 - р - родина у Стануму.
4. Елементи кожної групи розділяються на дві підгрупи: головну (елементи s- і p- родин) і побічну (елементи d - і f- родин). Тому Ti - елемент побічної підгрупи, а Sn – елемент головної підгрупи.
5. До металів згідно з електронною формулою відносять всі s - (за винятком Н і Не), d - та f -елементи, а також p -елементи великих періодів з одним або двома електронами. Неметалами є p -елементи з 3-6 електронами на р -підрівні (за винятком Sb, Bi, Po). Тому Титан – метал, тому що він є d- елементом, Станум – також метал, тому що він - елемент великого періоду з двома зовнішніми р- електронами.
6. Валентність (В) елемента визначають кількістю неспарених електронів, тобто електронів, які знаходяться на АО поодинці. Максимальна валентність елемента досягається у збудженому стані і зазвичай дорівнює номеру групи у таблиці. Для Титану і Стануму:
Ti: …3 d  d
d  d
d  d
d  d
d 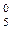 4 s
4 s 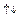 ; Sn: …5 s
; Sn: …5 s  5 p
5 p  p
p  p
p 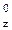 .
.
Зі схем видно, що у нормальному стані (стан, який відповідає мінімальній енергії атома) Титан і Станум двохвалентні (В = ІІ). При збудженні атом поглинає квант енергії та переходить у стан з більшою енергією - збуджений стан. При цьому один зі спарених валентних електронів переходить на вільну АО підрівня з більшою енергією, але на тому ж самому енергетичному рівні:
Ti: …3 d 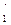 d
d 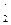 d
d  d
d  d
d 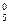 4 s
4 s 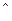 4 p
4 p  В = IV;
В = IV;
Sn: …5 s 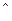 5 p
5 p  p
p  p
p  В = IV.
В = IV.
Таким чином, унаслідок переходу в збуджений стан валентність Титану і Стануму збільшується на дві одиниці і стає IV.
7. Наприкінці аналізу потрібно навести формулу вищого оксиду елемента, визначити його кислотно-основний характер і навести формулу відповідного гідроксиду (основи, кислоти, або і першого, і другого). Пам’ятаємо, що оксиди чотирьохвалентних металів амфотерні, тому вищому оксиду титану TiО2 відповідають водночас і основа Тi(OH)4, і кислота H2TiO3, а вищому оксиду стануму SnО2 - відповідно основа Sn(OH)4 та кислота H2SnO3.
Треба розрізняти електронні формули атомів та їх іонів. Якщо атом втрачає електрони, він перетворюється у позитивно заряджений іон - катіон. При цьому в першу чергу від’єднуються s- і p - електрони зовнішнього рівня, а потім – d- електрони передостаннього рівня. Наприклад,
Ti2+: …3 d 24 s 0; Ti4+: …3 d 04 s 0.
Здатність атомів елементів віддавати валентні електрони характеризується енергією іонізації. Для металів енергія іонізації має відносно низькі значення.
Якщо атом приєднує електрони, він перетворюється у негативно заряджений іон - аніон, наприклад:
15P: 1 s  2 s
2 s  2 p
2 p  3 s
3 s  3 p
3 p  + 3 е ® P
+ 3 е ® P  : 1 s
: 1 s  2 s
2 s  2 p
2 p  3 s
3 s  3 p
3 p  .
.
Здатність атомів елементів приєднувати “зайві” електрони характеризується енергією спорідненості до електрона. Великі значення цієї енергії характерні для неметалів. Значення енергій іонізації та спорідненості до електрона для кожного елемента закономірно пов’язані з його положенням у таблиці Д.І. Менделєєва.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 723; Нарушение авторских прав?; Мы поможем в написании вашей работы!