
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. Література:1. І.Є.Манековська
|
|
|
|
ЛАБОРАТОРНА РОБОТА № 4
ЗАЛЕЖНІСТЬ ШВИДКОСТІ ГОМОГЕННОЇ РЕАКЦІЇ ВІД КОНЦЕНТРАЦІЇ РЕАГУЮЧИХ РЕЧОВИН
Література: 1. І.Є.Манековська. Хімія. Інтерактивний комплекс навчально-методичного забезпечення. Рівне – 2006. с.93-99.
2. І.Є.Манековська, М.В.Яцков. Хімія, частина 1 (загальнотеоре-тична). Рівне – 2004, с.85-92.
Класичним прикладом гомогенної реакції є взаємодія між розчинами натрій тіосульфату і сільфатної кислоти, яка відбувається за рівнянням:



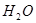

Сірка утворює з водою колоїдний розчин – з’являється ледь помітна каламуть.
Для визначення швидкості реакції необхідно виміряти секундоміром час від моменту зливання розчинів до появи каламуті. Знаючи час перебігу реакції 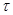 , легко визначити відносну
, легко визначити відносну
швидкість реакції, яка є величиною, оберненою часу: 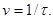
Хід роботи
На стінках восьми сухих пробірок проставте восковим олівцем номери: 1, 2, 3, 4, 1а, 2а, 3а, 4а. В перші чотири пробірки налийте з бюретки (відлік за нижнім меніском) по 6 мл 2н. розчину сульфатної кислоти. В інші чотири пробірки налийте з бюреток вказане в таблиці число мілілітрів розчину натрій тіосульфату і води. Наведену таблицю перепишіть в лабораторний журнал.
Влийте вміст пробірки 1а в пробірку 1 та в той же час увімкніть секундомір, перемішайте розчини в пробірці, затуливши отвір її великим пальцем і перевертаючи дном доверху і назад. Як тільки помітите слабку каламуть, вимкніть секундомір. Запишіть результат в таблицю.
| № про-бірки | Об’єм, мл | Відносна концерн-
трація
Na2S2O3

| Час
(за секун-доміром),
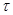
| Швидкість реакції
х 100

| |
| розчину Na2S2O3 а | Н2О b | ||||
| 1а | |||||
| 2а | 2/3 | ||||
| 3а | 1/2 | ||||
| 4а | 1/3 |
|
|
|
Зробіть аналогічні досліди з розчинами в усіх інших пробірках. За одержаними даними побудуйте на міліметровому папері графік залежності між швидкістю реакції (ось ординат) і концентрацією (ось абсцис). Зручний масштаб: максимальна концентрація 9 см, максимальна швидкість 8 см. Графік вклейте в журнал.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 286; Нарушение авторских прав?; Мы поможем в написании вашей работы!