
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Самопроизвольные и несамопроизвольные процессы.
Направление самопроизвольного протекания процессов. Второе начало термодинамики.
1) самопроизвольные процессы, протекание которых не требует затрат энергии извне; с их помощью можно получить работу
2) несамопроизвольные процессы, для проведения которых необходимо затратить энергию или совершить работу.
Для любого процесса важно установить критерий, определяющий возможность его самопроизвольного протекания в данных условиях. Первый закон термодинамики такого критерия не дает, в действительности возможно самопроизвольное протекание как экзо-, так и эндотермических процессов, например:
NH4NO3 (к) ® NH4NO3 (р) DH > 0
CaCl2 (к) ® CaCl2 (р) D H < 0
Таким образом, знак теплового эффекта процесса не определяет однозначно возможность его самопроизвольного протекания.
Второй закон термодинамики позволяет установить возможность и пределы самопроизвольного протекания процесса, а также определить, какая часть энергии системы может быть превращена в работу.
Рассмотрим процесс смешения двух инертных газов, для которого DH»0:
 |
состояние 1 состояние 2
Очевидно, что переход системы из состояния 1 в состояние 2 происходит самопроизвольно, а самопроизвольное протекание обратного процесса невозможно. Энергия системы в обоих состояниях одинакова и не может быть движущей силой смешения газов. В то же время, в состоянии 2 система характеризуется большей степенью беспорядка, чем в состоянии 1. Кроме того, состояние 2 более вероятно, чем состояние 1, так как трудно представить, чтобы два газа, не разделенные перегородкой, не смешались. Следовательно, движущей силой процесса смешения газов является стремление системы перейти в состояние с большей степенью беспорядка, которое для любой системы является наиболее вероятным.
Таким образом, процессы, протекающие без изменения энергии системы, идут самопроизвольно в направлении наиболее вероятного состояния этой системы, т. е. состояния с наибольшей степенью беспорядка.
Для количественной оценки вероятности состояния системы используют понятие термодинамическая вероятность W. Термодинамическая вероятность состояния системы – это число микросостояний (число способов), с помощью которых может быть реализовано данное макросостояние системы. Макросостояние системы определяется температурой, давлением, объемом и другими параметрами состояния системы. Микрокросостояние системы складывается из мгновенных характеристик всех частиц, образующих систему (атомов, молекул и т.д.), – их координат, скорости движения, энергии. Каждому макросостоянию отвечает огромное число микросостояний. Для удобства расчетов в термодинамике используют величину, пропорциональную lnW, отнесенную к одному молю вещества:
S = RlnW,
где R- универсальная газовая постоянная [Дж/моль К].
Величину S называют энтропией системы и измеряют в Дж/моль К.
Энтропия является мерой беспорядка системы. Чем больше степень беспорядка в системе, тем выше ее энтропия. Состояние системы с большей энтропией (с большим беспорядком) более вероятны.
Таким образом, процессы, протекающие без изменения энергии системы, идут самопроизвольно в направлении увеличения энтропии системы.
Энтропия – это функция состояния системы. Ее изменение DS в процессе может быть рассчитано на основании закона Гесса и его следствий.
В отличие от внутренней энергии и энтальпии абсолютное значение энтропии поддается определению, так как она имеет нулевую точку отсчета.
Согласно третьему закону термодинамики:
Энтропия идеального кристалла при 0 К равняется нулю.
Энтропии веществ в стандартном состоянии 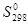 [Дж/моль К] определены и приводятся в справочных таблицах.
[Дж/моль К] определены и приводятся в справочных таблицах.
Энтропия зависит от температуры, от агрегатного состояния вещества, от давления (для гозов).
Иногда знак изменения энтропии в процессе можно оценить без точных расчетов. Так, изменения энтропии вещества при плавлении и испарении положительны: DSпл>0, DSисп>0, причем DSпл>DSпл.
Знак DS в ходе химической реакции можно оценить, не прибегая к точным расчетам, только в том случае, если процесс сопровождается изменением числа молей газообразных веществ:
CaCO3(к) ® CaO(к) + CO2(г) DS>0
N2(г) + 3 H2(г) ® 2 NH3(г) DS<0
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 765; Нарушение авторских прав?; Мы поможем в написании вашей работы!