
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II. Изучение равновесия гомогенной реакции в растворе
|
|
|
|
Контрольные вопросы
Расчет теплоты образования кристаллогидрата
4.2.1. Построить графики в координатах t, 0C = f (τ, мин) на миллиметровой бумаге для трех опытов (KCl, CuSO4, CuSO4 . H2O).
4.2.2. Определить графическим способом изменение температуры Δ t, как показано на рис.2, для трех опытов  .
.
4.2.3. Рассчитать постоянную калориметра аналогично п.4.1.3.
4.2.4. Рассчитать молярную теплоту растворения CuSO4, Дж/моль:
ΔНCuSO4 = 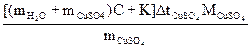 .
.
4.2.5. Рассчитать молярную теплоту растворения CuSO4 . 5Н2О, Дж/моль:
ΔНCuSO4.5H2O = 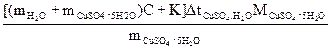 .
.
4.2.6. Рассчитать молярную теплоту образования кристаллогидрата ΔНCuSO4.5H2O по формуле (5).
4.2.7. Сделать выводы и оформить отчет.
5.1. Изменение теплоемкости в ходе реакции в некотором интервале температур меньше нуля. Как изменяется тепловой эффект этой реакции при повышении температуры в данном интервале?
5.2. Рассчитать разницу между ΔU0298 и ΔН0298 для реакции:
СН3СНО(г) + Н2 → С2Н5ОН(ж).
5.3. Сформулировать закон Гесса.
5.4. Написать уравнение реакции, к которой относится стандартная теплота образования жидкого этилового спирта.
5.5. При 298 К сера сгорает до SO3. Какая величина больше для этой реакции: ΔU0298 или ΔН0298?
5.6. В некотором интервале температур ΔН реакции с повышением температуры убывает. Каков вид и взаимное расположение в данном интервале температур кривых зависимости теплоемкости конечных продуктов и исходных веществ от температуры?
5.7. Как рассчитать теплоту сгорания органического соединения, располагая данными по теплотам образования различных веществ?
5.8. Как зависит тепловой эффект химической реакции от температуры и чем определяется характер этой зависимости?
5.9. В каких случаях для химической реакции можно принебречь разницей между ΔU и ΔН?
5.10.Написать реакцию, к которой относится теплота сгорания нитрофенола.
5.11. В некотором интервале температур зависимость ΔН реакции от температуры проходит через максимум. Изобразить графически зависимости сумм теплоемкостей конечных и исходных веществ этой реакции от температуры.
5.12 Рассчитать разницу между ΔU0298 и ΔН0298 для реакции:
Mg(OH)2(kp) → MgO(кр) + Н2О(газ).
5.13. Для некоторой реакции зависимость теплового эффекта от температуры выражается уравнением:
ΔН = -68710 + 36,77Т – 38,56 . 10-3Т2 + 8,21 . 10-6Т3 + 2,88 . 105Т-1.
Найти уравнение зависимости ΔСр этой реакции от температуры.
5.14 В интервале температур 273-298 К удельная теплоемкость графита больше удельной теплоемкости алмаза на 0,215 Дж/г . К. Как изменится тепловой эффект реакции перехода графита в алмаз при повышении температуры от 273 до 298 К?
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2030; Нарушение авторских прав?; Мы поможем в написании вашей работы!