
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть
|
|
|
|
3.1. Приборы и реактивы: термостат, колбы мерные с притертыми пробками емкостью 100 см3, колбы конические для титрования емкостью 100 см3, пипетки, бюретка, 0,03 М раствор Fe2(SO4)3, 0,03 M раствор RJ, 0б\,015 М раствор Na2S2O3, раствор крахмала.
3.2. Порядок выполнения работы
Взять четыре пронумерованные сухие мерные колбы емкостью 100 см3, налить в них растворы в соответствии с таблицей 2
Таблица 2
| Раствор, см3 | Колба 1 | Колба 2 | Колба 3 | Колба 4 |
| 0,03 М Fe2(SO4)3 | - | - | ||
| 0,03 М KJ | - | - |
Приготовить для титрования 8 конических колб емкостью 100 см3. В каждую колбу налить 30-35 см3 дистиллированной воды и поставить для охлаждения в лед.
Слить вместе содержимое 1 и 2 колб, отметив момент сливания по часам. Через 10 минут слить содержимое 3 и 4 колб и также отметить время. Колбы плотно закрыть пробками. Через 20 минут после сливания из каждой колбы отобрать пипеткой 15 см3 раствора и поместить их в колбы для титрования с охлажденной водой. Время отбора пробы считать с точностью до 1 минуты. Сразу после сливания выделившийся иод титровать 0,015 М раствором Na2S2O3 до бледно-желтой окраски. Затем добавить несколько капель раствора крахмала и титровать до исчезновения синего окрашивания. Отбор проб повторить через 40, 60, 80 минут от момента сливания. Одинаковое количество (см3) гипосульфита, израсходованное на титрование в двух последовательно взятых пробах из каждой колбы, указывает на достижения равновесия в реакции. Записать температуру опыта по комнатному термометру. Опытные данные занести в таблицу 3.
Таблица 3
| Колбы | Т, К | Результаты титрования, VNa 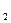 S S 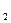 O O 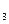 , см3 , см3
| |||
| Т1 | 20 мин | 40 мин | 60 мин | 80 мин | |
| 1 – 2 3 – 4 | |||||
| Колбы | Т2 | 10 мин | 20 мин | 30 мин | 40 мин |
| 1 – 2 3 – 4 |
Повторить эксперимент при другой температуре (по указанию преподавателя), помещая колбы с растворами в термостат и проводя отбор проб через 10, 20, 30 и 40 минут от момента сливания. Экспериментальные данные занести в таблицу 3.
4. Обработка экспериментальных данных
4.1.Концентрация иода в состоянии равновесия:
СJ 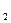 =
= 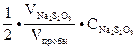 .
.
4.2. Концентрация ионов Fe2+: CFe 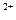 = 2CJ
= 2CJ 
4.3. Концентрация ионов Fe3+: CFe  = CFe
= CFe  (SO
(SO 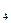 )
) 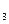 - CFe
- CFe 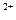
где CFe 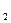 (SO
(SO 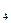 )
) 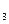 = C0 Fe
= C0 Fe 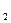 (SO
(SO 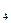 )
) 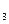 .
. 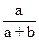 ,
,
а и b – объемы раствор Fe2(SO4)3 и KJ соответственно, взятые для проведения реакции.
4.4. Концентрации ионов J-: СJ  = CKJ – 2CJ
= CKJ – 2CJ 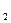 ,
,
где CKJ = C0 KJ . 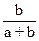 .
.
4.5. Константы равновесия для двух опытов при двух температурах:
К = 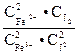 .
.
4.6. Среднее К для каждой температуры Т1 и Т2:
КТ 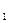 =
= 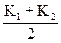 .
.
4.7. Занести в таблицу 4 для расчетов.
Таблица 4
| Номер колбы | Температура | CJ 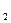
| CFe 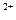
| CFe 
| СJ 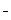
| К | Кср |
| 1 – 2 | Т1 | К1 | КТ 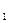
| ||||
| 3 – 4 | К2 | ||||||
| 1 – 2 | Т2 | К3 | КТ 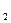
| ||||
| 3 - 4 | К4 |
4.8. Рассчитать изменение свободной энергии Гиббса при двух температурах:
ΔG  = - RT1lnKT
= - RT1lnKT 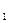 , ΔG
, ΔG 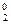 = - RT2lnKT
= - RT2lnKT 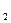 ,
,
где R = 8,314 Дж/моль . К
4.9. Рассчитать изменение энтальпии по уравнению изобары Вант-Гоффа:
а) аналитически из уравнения (13):
ΔН = 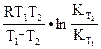
Б) графически из уравнения (12). Для этого необходимо построить график в координатах lnK = f(1/T) как показано на рисунке 3.
 ln K
ln K
 |

 ln KT2
ln KT2

 ln KT1
ln KT1
 |
1/T2 1/T1 1/T
Рис. 3
Найти коэффициенты в уравнении (12):
А = 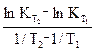 . В1 = lnKT
. В1 = lnKT  -
- 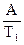 В2 = lnKT
В2 = lnKT 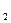 -
- 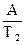
В = 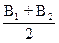
Найти графическое значение изменения энтальпии из уравнения (12):
ΔНгр = - RA.
4.10. Записать уравнение зависимости К от Т в интегральной форме, подставив значения А и В.
4.11. Рассчитать изменение энтропии, Дж/моль . К:
ΔST 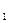 =
= 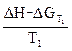 ΔST
ΔST 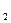 =
= 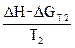
Данные расчетов занести в таблицу 5.
Таблитца 5
| Температура | К | А | В | ΔН, Дж/моль | ΔG, Дж/моль . К | ΔS, Дж/моль . К | |
| Т1 | Анал. | Граф. | |||||
| Т2 |
4.13 Сформулировать выводы о работе, оформить отчет.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 515; Нарушение авторских прав?; Мы поможем в написании вашей работы!