
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
РЫБИНСК 2007 3 страница
|
|
|
|
Процессы смешения рассматриваются обычно происходящими без теплообмена смешивающейся системы с окружающей средой, т. е. протекающими адиабатно. Смешение при наличии теплообмена можно разбить на два этапа: адиабатное смешение без теплообмена и теплообмен в полученной смеси с окружающей средой.
С целью упрощения выводов рассмотрим смешение двух реальных газов. Одновременное смешение трех и более газов может быть найдено с помощью расчетных формул для двух газов путем последовательного добавления нового компонента.
Все случаи смешения представляют собой необратимые процессы хотя бы потому, что для разделения смеси на ее составляющие обязательно требуется затрата работы. Как во всяком необратимом процессе, при смешении имеет место приращение энтропии 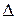 S c системы и соответствующие потери работоспособности (эксергии): De = T о.с
S c системы и соответствующие потери работоспособности (эксергии): De = T о.с 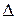 S c, где T о.с – температура окружающей среды.
S c, где T о.с – температура окружающей среды.
При смешении газов, имеющих различные давление и температуру, возникают дополнительные потери работоспособности от необратимого теплообмена между смешиваемыми газами и от неиспользования разности их давлений. Таким образом, увеличение энтропии при смешении происходит как в результате собственно смешения (диффузии) различных по своей природе газов или жидкостей, так и за счет выравнивания температур и давлений смешиваемых веществ.
Рассмотрим возможные способы смешения.
2.1. Процессы смешения в постоянном объеме
Пусть некоторый теплоизолированный сосуд объема V разделен перегородкой на два отсека, в одном из которых находится газ (жидкость) с параметрами p 1, u1, T 1, U 1, в другом – другой газ (жидкость) с параметрами p 2, u2, T 2, U 2, (рис. 2.1).
|
|
|
| V 1 p 1, T 1, u1, U 1, m 1 | V 2 p 2, T 2, u2, U 2, m 2 |
| V, p, T, u, U, m |
Рис. 2.1. Схема процесса смешения
в постоянном объеме
Массу газа в одном отсеке и объем этого отсека обозначим соответственно m 1 и V 1, а в другом отсеке – m 2 и V 2. При снятии разделяющей перегородки каждый газ путем диффузии распространится на весь объем, а результирующий объем смеси будет равен, очевидно, сумме V = V 1 + V 2. В результате смешения давление, температура и плотность газа по всему объему сосуда выравниваются. Значения параметров состояния газа после смешения обозначим p, u, T, U.
Согласно закона сохранения энергии, полученная смесь газов будет обладать внутренней энергией, равной сумме внутренних энергий каждого газа:
U = U 1 + U 2
или
m 1 u 1 + m 2 u 2 = (m 1 + m 2) u = mu. (2.1)
Удельная внутренняя энергия газа после смешения определяется следующим образом:
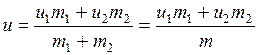 . (2.2)
. (2.2)
Аналогично, удельный объем смеси равен:
 . (2.3)
. (2.3)
Что касается остальных параметров газа после смешения (p, T, S), то для газов и жидкостей они аналитически в общем виде через значения параметров компонентов смеси не могут быть рассчитаны. Для их определения необходимо воспользоваться U, u-диаграммой, на которой нанесены изобары и изотермы или U, T -диаграммой с нанесенными на ней изохорами и изобарами (для смешения одного и того же газа), или таблицами термодинамических свойств газов и жидкостей. Определив с помощью соотношений (2.2) и (2.3) и u газа после смешения, из диаграмм или таблиц можно найти p, T, S.
Значения p, T и S газа после смешения могут быть непосредственно выражены через известные значения параметров состояния смешиваемых порций только для идеальных газов. Обозначим среднее значение теплоемкости первого газа в интервале температур от T 1 до T через 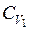 , а другого газа в интервале температур от T 2 до T через
, а другого газа в интервале температур от T 2 до T через 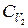 .
.
Учитывая, что  ;
;  ;
; 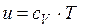 из выражения (2.2), получим:
из выражения (2.2), получим:
T = 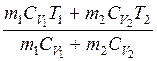 или T =
или T =  , (2.4)
, (2.4)
где g 1 и g 2 – массовые доли идеальных газов, составляющих смесь.
|
|
|
Из уравнения состояния идеальных газов следует:
m 1 =  ; m 2 =
; m 2 = 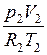 .
.
После подстановки значений масс в (2.4) температура газовой смеси может быть найдена из выражения
T =  . (2.5)
. (2.5)
Давление смеси идеальных газов определим как сумму парциальных давлений компонентов газовой смеси  , где парциальные давления
, где парциальные давления 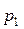 и
и 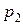 определяются с помощью уравнения Клапейрона.
определяются с помощью уравнения Клапейрона.
 ;
; 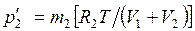 .
.
Тогда
 . (2.6)
. (2.6)
Приращение энтропии 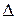 S c системы от необратимого смешения находят по разности сумм энтропии газов, входящих в смесь, после смешения и исходных компонентов до смешения:
S c системы от необратимого смешения находят по разности сумм энтропии газов, входящих в смесь, после смешения и исходных компонентов до смешения:
 S = S – (m 1 S 1 + m 2 S 2).
S = S – (m 1 S 1 + m 2 S 2).
Для смеси идеальных газов при смешении двух газов [1, 2, 3].
 Sc = m [(g 1 Cp 1 + g 2 Cp 2) ln T – (g 1 R 1 + g 2 R 2) ln p ]–
Sc = m [(g 1 Cp 1 + g 2 Cp 2) ln T – (g 1 R 1 + g 2 R 2) ln p ]–
– [ m 1(Cp 1 ln T 1 – R ln p 1) + m 2(Cp 2ln T 2 – R ln p 2)]–
–m (R 1 g 1ln r 1 + R 2 g 2ln r 2),
где ri – объемная доля идеальных газов, составляющих смесь;
R – газовая постоянная смеси, определяемая уравнением:
R = g 1 R 1 + g 2 R 2.
Диаграмма эксергии и анергии при смешении в постоянном объеме представлена на рис. 2.2.
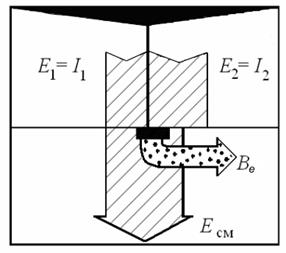 Рис. 2.2. Диаграмма эксергии и анергии при
смешении в постоянном объеме:
Рис. 2.2. Диаграмма эксергии и анергии при
смешении в постоянном объеме:  – потери удельной эксергии при смешении – потери удельной эксергии при смешении
|
2.2. Задание для самостоятельной проработки
Сосуд, теплоизолированный от окружающей среды, разделен адиабатными перегородками на четыре объема, в каждом из которых содержится определенный газ. После того как перегородки убраны, происходит смешение в постоянном объеме, равным сумме объемов четырех частей с разными газами. Состояние газов до смешения характеризуются параметрами: массой 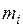 , кг, объемом
, кг, объемом  , м3; температурой
, м3; температурой 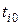 , °С, где (
, °С, где (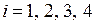 ). Данные для расчета необходимо брать в табл. 2 Приложения 1 в соответствии с заданным номером варианта.
). Данные для расчета необходимо брать в табл. 2 Приложения 1 в соответствии с заданным номером варианта.
В процессе работы над индивидуальным домашнем заданием необходимо определить:
– температуру смеси после завершения процесса смешения –  , °С;
, °С;
– давление газовой смеси –  , МПа;
, МПа;
– газовую постоянную газовой смеси, кДж/(кг·К);
– кажущуюся молярную массу смеси –  , кг/моль;
, кг/моль;
– состав газовой смеси в массовых долях;
– парциальные давления компонентов смеси – 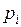 , МПа;
, МПа;
– истинную мольную теплоемкость смеси при 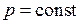 для температуры установившейся после смешения
для температуры установившейся после смешения  , кДж/(кг·К);
, кДж/(кг·К);
– найти приращение энтропии системы в процессе необратимого смешения, кДж/К;
– рассчитать эксергию компонентов, газовой смеси и потери эксергии в процессе смешения: 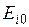 ,
, 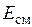 ,
,  , кДж/К;
, кДж/К;
|
|
|
– построить эксергетическую диаграмму процесса смешения в постоянном объеме.
При выполнении расчета процесса смешения счить компоненты смеси идеальными газами. При определении истинной и средней теплоемкостей, данные брать по табл. 1-5 Приложения 2. При вычислении воспользоваться линейной интерполяцией.
Температуру смеси после окончания процесса смешения найти графически или методом последовательных приближений. При этом начальное приближение для температуры смеси можно вычислить, пологая теплоемкости компонентов смеси равными, по следующей зависимости:
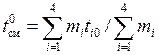 .
.
Точность вычисления температуры смеси должна быть не менее 1 К. В расчетах использовать систему СИ единиц.
2.3. Пример выполнения расчета
Сосуд разделен перегородкой на две части, объемы которых
V 1 = 1,5 м3 и V 2 = 1 м3. В первой части содержится азот массой m 1 = 10 кг при температуре t 1 = 120 °C; в другой части – гелий массой m 2 = 5 кг при
t 2 = 860 °C. Найти давление, температуру и энтропию смеси после того, как перегородка будет убрана и процесс смешения закончится.
Решение.
Воспользуемся законом сохранения энергии (2.1) и запишем:
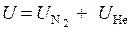
или через удельные энтальпии с учетом выклада каждого из компонентов
 ,
,
где массовые доли азота и гелия найдем из выражения
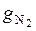 =
= 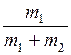 ; g He =
; g He = 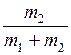 .
.
Удельную внутреннюю энергию азота находим по табл. 1 Приложения 2, а удельную внутреннюю энергию гелия u He воспользовавшись положениями молекулярно-кинетической теории. Гелий – одноатомный газ, у которого, имеются три степени свободы. Тогда выражение для удельной внутренней энергии может быть записано в виде
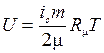 ;
; 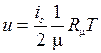
или после подстановки численных значений величин, входящих в зависимость
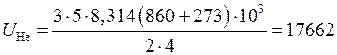 кДж;
кДж;
 кДж/кг.
кДж/кг.
Удельная внутренняя энергия азота из таблиц  кДж/кг
кДж/кг
или если рассчитать по изложенной методике
 кДж;
кДж;
 кДж/кг.
кДж/кг.
Рассчитаем удельную внутреннюю энергию заданной смеси азота и аргона:
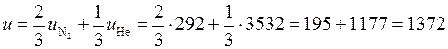 кДж/кг.
кДж/кг.
Для определения средней температуры, используя отмеченную методику, рассчитаем внутреннюю энергию смеси при температурах, находящихся в области предполагаемого численного значения искомой величины. Результаты внесем в табл. 2.1.
|
|
|
По полученным данным, пользуясь интерполяцией или графиком
t = f (u), построенным с использованием результатов расчета находим температуру газовой смеси.
По графику 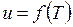 (рис. 2.3) находим, что температура смеси составляет ~611 °С.
(рис. 2.3) находим, что температура смеси составляет ~611 °С.
| t, °C | T, К | 
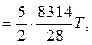 кДж/кг кДж/кг
| u He= 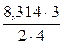 T, кДж/кг T, кДж/кг
| g N2 u N2, кДж/кг | g He u He, кДж/кг | u =
= 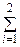 giui
кДж/кг giui
кДж/кг
|
Таблица 2.1
Воспользуемся уравнением состояния Клапейрона-Менделеева и найдем парциальные давления компонентов смеси
 Рис. 2.3. Зависимость температуры смеси от ее удельной внутренней энергии
Рис. 2.3. Зависимость температуры смеси от ее удельной внутренней энергии
|

где V – объем газовой смеси 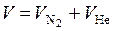 .
.
Парциальное давление азота:
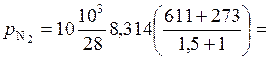
 МПа.
МПа.
Парциальное давление гелия:
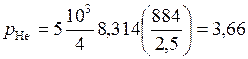 МПа.
МПа.
Давление газовой смеси в соответствии с законом Дальтона найдем как сумму парциальных давлений
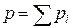 или
или  МПа.
МПа.
Массовые доли компонентов
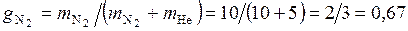 ;
;
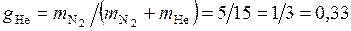 ;
;

Газовая постоянная смеси

Кажущая молярная масса газовой смеси
 кг/моль.
кг/моль.
Объемные доли компонентов
 ;
;
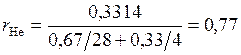 .
.
Рассчитаем давление смеси
 .
.
Парциальные давления компонентов
 ;
;
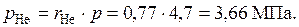
Давление смеси 
Рассчитывая энтропию смеси сделаем предположение о том, что при 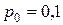 МПа и
МПа и  °С, т. е. при нормальных физических условиях, энтропия газов (
°С, т. е. при нормальных физических условиях, энтропия газов (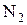 и
и  ) равна нулю. Такое допущение правомочно, т. к. нас интересует не абсолютная величина энтропии, а ее отклонение от некоторого уровня, выбранного в осуществляемом расчете за нулевой. Энтропия газов до смешения равна сумме энтропии 10 кг азота и 5 кг гелия. Для их определения по известным начальным состояниям азота и гелия выпишем из таблиц Приложения 2 необходимые при расчете значения теплоемкостей.
) равна нулю. Такое допущение правомочно, т. к. нас интересует не абсолютная величина энтропии, а ее отклонение от некоторого уровня, выбранного в осуществляемом расчете за нулевой. Энтропия газов до смешения равна сумме энтропии 10 кг азота и 5 кг гелия. Для их определения по известным начальным состояниям азота и гелия выпишем из таблиц Приложения 2 необходимые при расчете значения теплоемкостей.
Найдем давления компонентов до смешения, воспользовавшись уравнением Клапейрона-Менделеева
 ;
;
 .
.
Теплоемкости компонентов из табл. Приложения 2:
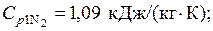

Удельная энтропия азота в начальном состоянии


Удельная энтропия гелия до смешения

Энтропия системы азот гелий до смешения равна сумме энтропий подсистем в соответствии с аддитивностью энтропии
 ;
;
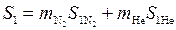 ;
;

Рассчитаем энтропию газовой смеси
 .
.
Подставим численные значения
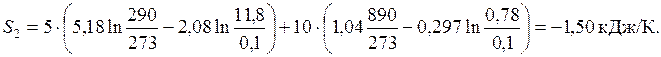 В расчете не учитывалась зависимость теплоемкости от температуры.
В расчете не учитывалась зависимость теплоемкости от температуры.
Рассчитаем приращение энтропии за счет необратимости процесса смешения


Потери эксергии в процессе смешения найдем, воспользовавшись уравнением Гюи-Стодолы:

Эксергия термодинамической системы из 10 кг азота и 5 кг гелия до смешения
 .
.
Энтропию компонентов при параметрах окружающей среды, как было ранее отмечено, будем считать равной нулю. Тогда для начального состояния гелия и азота рассчитаем численные значения внутренней энергии и удельных объемов. Предполагая газы идеальными, воспользуемся зависимостью внутренней энергии от температуры и удельной изохорной теплоемкости
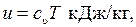
где массовая теплоемкость может быть выражена через мольную теплоемкость и молярную массу газа  .
.
Мольная теплоемкость газа с использованием молекулярно кинетических основ в рамках классической термодинамики равна:
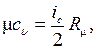
где iс – число степеней свободы молекулы газа.
Для гелия как одноатомного газа 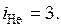
Для двухатомного азота 
Тогда удельная внутренняя энергия гелия равна:

Для азота

Удельные объемы компонентов до смешения найдем, воспользовавшись исходными данными
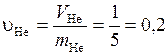 м3/кг;
м3/кг;
 м3/кг.
м3/кг.
Удельные объемы компонентов при нормальных условиях найдем, воспользовавшись уравнением Клапейрона-Менделеева
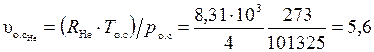 м3/кг;
м3/кг; 
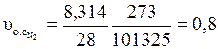 м3/кг.
м3/кг.
Рассчитаем суммарную эксергию азота и гелия до процесса смешения

Подставим численные значения

Удельные внутренние энергии гелия  и
и
азота 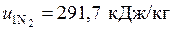 взяты из таблиц Приложения 2.
взяты из таблиц Приложения 2.
Определим эксергию образовавшейся газовой смеси

Из таблиц Приложения 2 найдем удельную внутреннюю энергию гелия и азота в состоянии соответствующим газовой смеси.
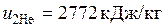 ;
; 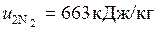 .
.
После подстановки рассчитаем численное значение эксергии газовой смеси:
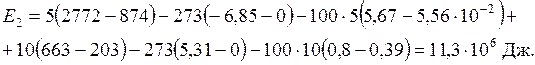
 Рис. 2.4. Эксергическая диаграмма смешения газов
в постоянном объеме
Рис. 2.4. Эксергическая диаграмма смешения газов
в постоянном объеме
|
Проверим правильность решения, рассчитав потери эксергии смешения и сравнив полученные значения с ранее рассчитанным результатом.
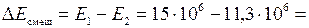
 Дж.
Дж.
Сопоставим результаты
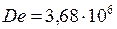 ≈
≈ 
Полученная точность расчетов вполне удовлетворительна. По рассчитанным значениям построим эксергетическую диаграмму процесса смешения в объеме.
2.4. Смешение в потоке
Схема смешения различных газов в потоке представлена на рис. 2.5. Пусть в единицу времени по первому трубопроводу в камеру смешения поступает m 1 кг первого газа с параметрами P 1, h 1, T 1 и скоростью W 1, а по второму трубопроводу – m 2 кг второго газа с параметрами P 2, h 2, T 2 и скоростью W 2. Из камеры смешения в единицу времени вытекает m 1 + m 2 = m кг газа с параметрами P, h, T и скоростью W.
Запишем первое начало термодинамики для открытой поточной системы, представленной на рис. 2.5.
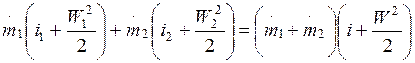 (2.7)
(2.7)
или после деления на поток массы смеси 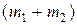 получим
получим
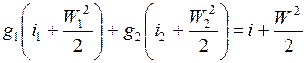 .
.
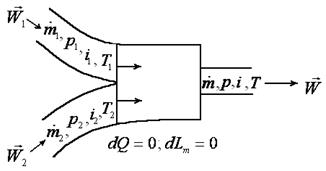 Рис. 2.5. Схема процесса смешения в потоке
Рис. 2.5. Схема процесса смешения в потоке
|
Во многих случаях смешения в потоках скорости W 1, W 2 и W подбирают примерно одинаковыми и к тому же относительно небольшими, что позволяет не учитывать изменение кинетической энергии газов. При этом закон сохранения энергии через удельные энтальпии имеет вид
g 1 i 1 + g 2 i 2 = i. (2.8)
Записанные уравнения (2.7) и (2.8) позволяют при заданном давлении p после смешения определить все прочие параметры смеси. Для этого надо воспользоваться таблицами термодинамических свойств смеси, по которым определить T = f (p, i), S = f (p, i) и другие параметры. При этом надо иметь в виду, что в общем случае давление смеси может быть как больше, так и меньше давления каждого газа. Иначе говоря, могут быть такие случаи, когда p 1> p > p 2; p 1> p < p 2; p 1< p < p 2. Все зависит от величины скорости на входе и выходе из камеры смешения.
В случае смешения потоков идеального газа, имеющих различные параметры, величины n и T могут быть выражены аналитически, через известные значения параметров смешиваемых потоков газа.
Поскольку для идеального газа, теплоемкость которого постоянна
i 1 = сp 1 T 1; i 2 = сp 2 T 2; i = сpT; (для идеального газа, теплоемкость которого зависит от температуры, в этих соотношениях будет фигурировать средняя теплоемкость), из формулы (2.2) получим:
 . (2.9)
. (2.9)
Зная определенную таким образом температуру T газа и давление p газа в камере смешения, с помощью уравнения Клапейрона-Менделеева нетрудно определим удельный объем газа после смешения:
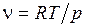 , (2.10)
, (2.10)
где R – газовая постоянная смеси.
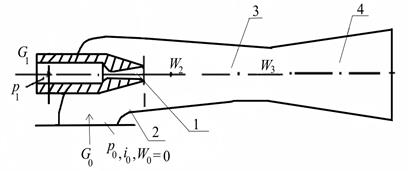 Рис. 2.6. Схема эжектора: 1 – активное сопло; 2 – пассивное сопло; 3 – камера смешения; 4 – диффузор
Рис. 2.6. Схема эжектора: 1 – активное сопло; 2 – пассивное сопло; 3 – камера смешения; 4 – диффузор
|
Примером смешения газов различных давлений служит пароструйный аппарат (эжектор), который состоит из сопла, камеры смешения и диффузора (рис. 2.6), [4].
Такой эжектор служит, например, компрессором в пароэжекторных холодильных установках, где втекающий под давлением p 0 пар низкого давления с помощью эжектирующего потока пара приобретает более высокое давление pm. Эжектирующий поток пара поступает (после расширения в сопле) в объем, где пар низкого давления практически находится в неподвижном состоянии: В этом объеме эжектирующий поток пара смешивается с паром низкого давления и вместе с ним втекает в диффузор. Здесь смесь тормозится и сжимается до давления p см > p 0 (рис. 2.6).
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!