
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса. Условие протекания физико-химических процессов
|
|
|
|
На практике большинство процессов протекает в закрытых системах, которые могут обмениваться теплотой или работой с окружающей средой. В таких системах количественным критерием самопроизвольного протекания процесса является полезная работа, которую можно получить в результате данного процесса. Полезная работа процесса в условиях равновесия равна убыли энергии Гиббса при Р–, Т–const; Ап = –DG, поэтому вместо полезной работы в качестве критерия самопроизвольности процессов можно использовать изменение энергии Гиббса, которую легко определить по DН и DS, используя уравнение
DG = DH – TDS. (13)
Знак и величина DG определяются знаками и величинами DН и DS, так как абсолютная температура всегда величина положительная (Т > 0).
Величину DG0 реакции можно рассчитать двумя способами.
С помощью уравнения 13 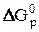 =
= 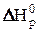 – Т
– Т 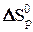 , где
, где 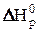 ,
, 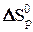 – стандартные значения изменений энтальпии и энтропии процесса.
– стандартные значения изменений энтальпии и энтропии процесса.
Величины 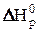 и
и 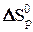 можно использовать для расчётов
можно использовать для расчётов 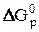 при различных температурах, так как в первом приближении можно считать, что величины изменения энтальпии и энтропии не зависят от температуры, т.е.
при различных температурах, так как в первом приближении можно считать, что величины изменения энтальпии и энтропии не зависят от температуры, т.е. 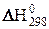 »
» 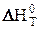 и
и  »
»  .
.
Энергия Гиббса является функцией состояния, поэтому изменение энергии Гиббса для химической реакции (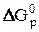 ) не зависит от пути перехода системы из начального состояния 1 в конечное состояние 2, т.е. от промежуточных стадий процесса, а обуславливается только природой и физическим состоянием исходных веществ и продуктов реакции. Поэтому DG0 реакции 8 равна разности
) не зависит от пути перехода системы из начального состояния 1 в конечное состояние 2, т.е. от промежуточных стадий процесса, а обуславливается только природой и физическим состоянием исходных веществ и продуктов реакции. Поэтому DG0 реакции 8 равна разности 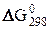 образования продуктов реакции и исходных веществ, т.е.
образования продуктов реакции и исходных веществ, т.е.
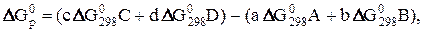 (14)
(14)
где 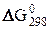 – стандартные энергии образования продуктов реакции и исходных веществ;
– стандартные энергии образования продуктов реакции и исходных веществ;
a, b, c, d – стехиометрические коэффициенты.
Стандартная энергия образования веществ равна изменению энергию Гиббса для реакции образования 1 моля вещества из простых веществ при стандартных условиях. Это определение подразумевает, что 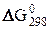 для простого вещества равна нулю. Единица измерения
для простого вещества равна нулю. Единица измерения 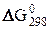 – кДж/моль.
– кДж/моль.
|
|
|
Значения DG0 процессов можно использовать для сравнительной характеристики реакционной способности химических соединений. Чем меньше алгебраическая величина DG0, тем больше возможность протекания соответствующего процесса в прямом направлении, тем выше химическое сродство веществ, участвующих в реакции.
Например, определить, как меняется устойчивость к нагреванию карбонатов металлов IIА группы МеСО3, если известны DG0 реакций получения их из соответствующих оксидов:
МеО(тв) + СО2(г) = МеСО3(тв).
| Вещество | ВеСО3(тв) | MgСО3(тв) | СаСО3(тв) | SrСО3(тв) | ВаСО3(тв) |
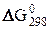 , кДж/моль , кДж/моль
| +16,5 | –66,2 | –131,2 | –184,5 | –218,9 |
Реакция разложения карбонатов обратна реакции образования их из соответствующего оксида и СО2:
МеСО3(тв) = МеО(тв) + СО2(г)
поэтому DG0 (обратной реакции) = –DG0 (прямой реакции). DG0 обратной реакции увеличивается от ВеСО3 (–16,5) к ВаСО3 (+218,9). Это значит, что единственным соединением из предложенных, которое легко распадается на оксиды в стандартных условиях является ВеСО3 (DG0 обратной реакции < 0).
Карбонат бария ВаСО3 является самым устойчивым к разложению, т.е. будет разлагаться при более высокой температуре. Эти выводы можно подтвердить значениями температур диссоциации карбонатов ( = 1 атм).
= 1 атм).
| Вещество | MgСО3(тв) | СаСО3(тв) | SrСО3(тв) | ВаСО3(тв) |
| tразлож., °С |
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 851; Нарушение авторских прав?; Мы поможем в написании вашей работы!