
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрическим методом
|
|
|
|
Растворения труднорастворимой соли
Определение термодинамических функций
Лабораторная работа
Растворения труднорастворимой соли кондуктометрическим методом
Определение термодинамических функций
Лабораторная работа
Лабораторные работы по физической химии
Цель работы: определить ПР, DH, DG и DS растворения труднорастворимой соли.
Общие положения
Зависимость растворимости от температуры выражается уравнением:
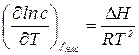 , (1)
, (1)
где D Н – дифференциальная теплота растворения соли, Дж/моль; с – концентрация насыщенного раствора, моль/л; R – универсальная газовая постоянная, Дж/(моль´град).
В насыщенном растворе существует равновесие между твердой солью и ее раствором:
МА ↔ М+ + А-
Для этого процесса константа равновесия Ка выражается уравнением:
 , (2)
, (2)
где  и
и  – активность катиона и аниона; аТ – активность твердой соли.
– активность катиона и аниона; аТ – активность твердой соли.
Известно, что активность твердой соли аТ = 1, следовательно при данной температуре произведение 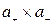 есть величина постоянная и называется произведением растворимости:
есть величина постоянная и называется произведением растворимости:
 . (3)
. (3)
Принимая во внимание что, ai=γici записываем:
 . (4)
. (4)
Для труднорастворимых соединений, при отсутствии в растворе других ионов, коэффициент активности будет равен 1 и тогда произведение растворимости можно записать в виде:
 . (5)
. (5)
Если в растворе кроме труднорастворимого соединения присутствует заметное количество других ионов, активность нельзя считать равным концентрации и ПР рассчитывается по уравнению (4). В этом случае коэффициенты активности определяют с помощью закона Дебая – Хюккеля:
 ; (6)
; (6)
где zi – заряд иона; I – ионная сила раствора:
 ;
;
mi – мольная концентрация i -го иона.
Уравнение (1) для бинарного (1-1 или 2-2 валентного электролита) может быть преобразовано:
|
|
|
 . (7)
. (7)
Дифференциальную теплоту растворения труднорастворимых соединений можно определить графически, построив график в координатах lnПР – 1/Т. По тангенсу угла наклона прямой к оси 1/Т находят дифференциальную теплоту растворения:
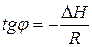 . (8)
. (8)
Исходя из полученного значения ПР:
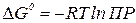 ; (9)
; (9)
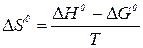 . (10)
. (10)
Одним из методов установления растворимости труднорастворимых соединений является метод электропроводности.
Найдя экспериментальную величину удельной электропроводности cс раствора исследуемой соли, рассчитывают концентрацию ионов в растворе:
С=cс /l0 (11)
Учитывая температурную зависимость подвижностей катиона и аниона соли, находят эквивалентную проводимость раствора при бесконечном его разбавлении по уравнению:
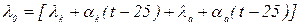 , (12)
, (12)
где aк и aа – температурные коэффициенты подвижности катиона и аниона при нормальной температуре.
Порядок проведения работы
Для определения электропроводности раствора труднорастворимой соли используют кондуктометр. Насыщенный раствор труднорастворимой соли готовят следующим образом. Небольшое количество соли растирают в ступке, помещают в плоскодонную колбу с притертой пробкой и два-три раза промывают дистиллированной водой для удаления легкорастворимых примесей. Отмытую соль заливают водой (100 мл) и, плотно закрывают колбу пробкой, непрерывно взбалтывать в течение 20 мин. Полученную суспензию отфильтровывают через стеклянный фильтр, а осадок используют для приготовления насыщенного раствора. Готовят еще такой же насыщенный раствор, и полученную суспензию отфильтровывают через осадок, специально нанесенный на фильтр. Такое фильтрование предупреждает образование пересыщенного раствора труднорастворимой соли. Раствор сливают в сосуд для измерения электропроводности, который погружают в термостат с температурой 30, 35, 40, 45°С, и после установления температуры раствора измеряют удельную проводимость раствора.
|
|
|
Таким образом, экспериментальная часть работы включает:
Приготовление насыщенного раствора труднорастворимой соли при температурах 30, 35, 40, 45°С и измерение cр исследуемого раствора при этих же температурах.
Задания
1. Вычислить молярную проводимость исследуемого раствора при бесконечном разбавлении по уравнению (12) при нужных температурах.
2. По уравнению (11) определить растворимость соли, а по уравнению (4) найти ПРТ для трех температур.
3. Построить график в координатах lnПРТ – 1/Т и по уравнению (7) рассчитать дифференциальную теплоту (DН) растворения соли.
4. Используя уравнения (9) и (10) найти DG0 и DS0.
По итогам исследований вычислите абсолютную и относительную ошибки. Следует знать, что для перевода удельной электропроводности в систему единиц СИ нужно умножить ее на 102. Чтобы перевести эквивалентную электропроводность и мольную, нужно разделить ее на 104 и умножить на зарядовое число молекул.
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 865; Нарушение авторских прав?; Мы поможем в написании вашей работы!