
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Топология молекул
|
|
|
|
С помощью энергетических профилей можно решать ряд важных химических задач, касающихся строения молекул.
Если выбрать в КП определенную точку (геометрическую конфигурацию), то для нее можно исследовать энергетические профили, соответствующие всем межъядерным расстояниям. При этом оказывается, что все эти профили можно отнести к одному из двух стандартных типов.
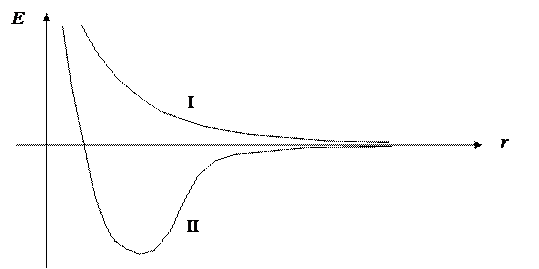 |
Соответственно, все пары ядер молекулы можно также подразделить на два типа:
несвязанные (энергетический профиль I типа)
связанные (энергетический профиль II типа)
Если ядра изобразить точками и точки, соответствующие связанным парам ядер, соединить линиями, получится графический образ молекулы — ее топологический граф Разновидностью таких графов являются известные структурные формулы классической химии.
С помощью топологического графа можно определить важную характеристику для определенной совокупности атомных ядер и электронов — химическую форму. Любой ХФ соответствует определенная область КП. Любая точка КП в этой области характеризуется одним и тем же топологическим графом.
Например, для линейной трехъядерной системы (A•••B•••C) КП двумерно и его можно изобразить на плоскости. Если ядра А, В и С соответствуют одновалентным атомам, то в КП существуют две области, соответствующие двум химическим формам:
 |
Переход через границу раздела между двумя разными ХФ соответствует некоторому химическому превращению, в ходе которой меняется топология или связность системы (одни химические связи исчезают, а другие появляются).
Совокупность таких химических форм и химических превращений для некоторой ядерно-электронной системы удобно изображать с помощью специального конфигурационного графа, в котором вершины соответствуют химическим формам, а ребра — химическим реакциям.
|
|
|
Если проанализировать одно из ребер такого графа с помощью ППЭ, то можно заключить, что химическое превращение должно осуществляться с наименьшими энергетическими затратами. Тогда ему будет соответствовать некоторая кривая в КП, соединяющая две ХФ. Такая кривая называется траекторией химического превращения (координатой реакции).
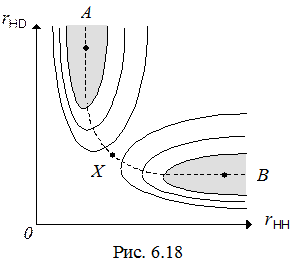
Построив вдоль этой траектории вертикальную поверхность, можно получить специальный энергетический профиль — профиль элементарного акта (элементарной химической реакции).
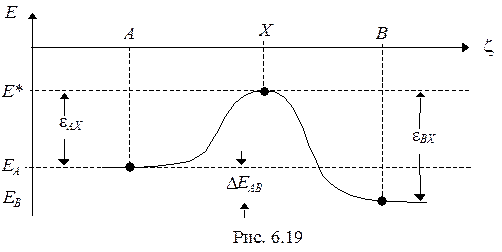
На таком профиле всегда имеются два минимума, соответствующие двум устойчивым состояниям — начальному и конечному. Разность энергий этих минимумов представляет собой важную характеристику ЭА — энергетический эффект (D Е), который можно использовать для оценивания энергетических эффектов (D Н) макроскопических химических процессов
Кроме того, относительные глубины минимумов определяют собой положение химического равновесия. Используя модель канонического ансамбля, можно получить константу равновесия в виде отношения заселенностей двух химических форм:
K = N II / N I = exp (– E II / kT) / exp (– E I / kT) = exp (– D Е / kT)
Между минимумами химических форм всегда находится разделяющий их энергетический (потенциальный) барьер, высота которого имеет важное значение для скорости химического превращения. Для преодоления барьера молекулы исходной ХФ должны получить извне порцию энергии, равную Еа (энергия активации). Как правило, эта энергия заимствуется молекулами из термостата. В этом случае с помощью фактора Больцмана можно оценить вероятность превращения, пропорциональную константе скорости реакции:
Р I®II ~ exp (– Ea / kT) ~ k
и обосновать известное равенство химической кинетики:
|
|
|
K = k ® / k
Вероятности переходов:
§ энергетический множитель,
§ стерический множитель,
§ трансмиссионый коэффициент.
Переходное состояние, его структура, связь с энергией активации.
Толщина потенциального барьера. Химическое расстояние.
Форма потенциального барьера. Постулат Хэммонда. Два типа химических реакций:
§ деформация электронной оболочки,
§ образование интермедиатов,
§ механизм реакции.
Геометрическая форма молекул:
§ длины связей и валентные углы,
§ тип формы (метод ОЭПВО).
Молекулы с флуктуирующей структурой:
§ топологические флуктуации,
§ геометрические флуктуации,
§ конформационные степени свободы.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1037; Нарушение авторских прав?; Мы поможем в написании вашей работы!