
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимический анализ процесса
|
|
|
|
Стехиометрия и материальные расчеты.
Сводная таблица расчета материального баланса.
| Компонент | M кг/кмоль | Взято | Получено | ||
| кмоль/ч | кг/ч | кмоль/ч | кг/ч | ||
| C3H8 | 44,097 | 437,5404 | 19294,22 | 30,62783 | 1350,595 |
| C2H4 | 28,054 | 406,9126 | 11415,53 | ||
| СН4 | 16,043 | 406,9126 | 6528,098 | ||
| Н2О | 18,015 | 437,5404 | 7882,29 | 437,5404 | 7882,29 |
| Σ | 875,0808 | 27176,51 | 1281,993 | 27176,51 |

Реакция эндотермическая, сопровождается поглощением тепла, поэтому при проведении реакции необходимо подводить тепло к зоне реакции.
Задаем температуру на входе в реактор Твх=1088К, в реактор поступает GС3Н8 =437,5404кмоль/час, GH2O=437,5404кмоль/час, степень конверсии 93%, Х=0,93.
При разбавлении пропана 1:4, т.е. 1 кмоль пропана на 4 кмоль воды.
| Взято | Получено | ||||
| Компонент | M кг/кмоль | кмоль/ч | кг/ч | кмоль/ч | кг/ч |
| C3H8 | 44,097 | 437,5404 | 19294,22 | 30,62783 | 1350,595 |
| C2H4 | 28,054 | 406,9126 | 11415,53 | ||
| СН4 | 16,043 | 406,9126 | 6528,098 | ||
| Н2О | 18,015 | 1750,162 | 31529,16 | 1750,162 | 31529,16 |
| Σ | 2187,702 | 50823,38 | 2594,615 | 50823,38 |
Разбавление 1 кмоль пропана на 6 кмоль воды.
| Взято | Получено | ||||
| Компонент | M кг/кмоль | кмоль/ч | кг/ч | кмоль/ч | кг/ч |
| C3H8 | 44,097 | 437,54039 | 19294,219 | 30,62782752 | 1350,59531 |
| C2H4 | 28,054 | 406,9125656 | 11415,52511 | ||
| СН4 | 16,043 | 406,9125656 | 6528,098289 | ||
| Н2О | 18,015 | 2625,2424 | 47293,741 | 2625,242358 | 47293,74109 |
| Σ | 3062,7828 | 66587,96 | 3469,695317 | 66587,9598 |
Разбавление 1 кмоль пропана на 7 кмоль воды.
| Взято | Получено | ||||
| Компонент | M кг/кмоль | кмоль/ч | кг/ч | кмоль/ч | кг/ч |
| C3H8 | 44,097 | 437,5404 | 19294,22 | 30,62783 | 1350,595 |
| C2H4 | 28,054 | 406,9126 | 11415,53 | ||
| СН4 | 16,043 | 406,9126 | 6528,098 | ||
| Н2О | 18,015 | 3062,783 | 55176,03 | 3062,783 | 55176,03 |
| Σ | 3500,323 | 74470,25 | 3907,236 | 74470,25 |
2Разбавление 1 кмоль пропана на 8 кмоль воды.
|
|
|
| Взято | Получено | ||||
| Компонент | M кг/кмоль | кмоль/ч | кг/ч | кмоль/ч | кг/ч |
| C3H8 | 44,097 | 437,54039 | 19294,219 | 30,62782752 | 1350,59531 |
| C2H4 | 28,054 | 406,9125656 | 11415,52511 | ||
| СН4 | 16,043 | 406,9125656 | 6528,098289 | ||
| Н2О | 18,015 | 3500,3231 | 63058,321 | 3500,323145 | 63058,32145 |
| Σ | 3937,8635 | 82352,54 | 4344,776103 | 82352,54016 |
По закону Гесса рассчитываем тепловой эффект реакции:
∆rH0т=Σ(vj∆fH0т)продукт - Σ(vi∆fH0т)исх
| пропан | метан | этилен | вода | ΔrH01088, кДж/моль | |
| ΔHf01088, кДж/моль | -135,6500 | -91,8600 | 43,5750 | -29,6836 | 87,3650 |
Таким образом в результате полученной энтальпии реакции ΔrH01088=87,3650 кДж/моль - процесс эндотермичный.
Qр=-∆rH0т*n*1000, Дж/ч
Qр=-87,365*1000*406,91=-35549916 Дж/ч
Рассчитываем количество тепла на входе в реактор: Qвх=Gвх*Cp*Tвх, Дж/ч
Qвх 1=437,5404*181,7*1088=86497946,96 Дж/ч в реактор пропана,
Qвх 2 =1750,1616*42,226*1088=80407288,36 Дж/ч воды;
Qвх общ= Qвх 1+ Qвх 2= 106599769,1 Дж/ч
Q'вых= Qвх+Qр, с учетом потерь в окружающую среду
Q'вых=106599769,1 –(-35549916)+ 106599769,1 *0,05=123010057 Дж/ч
Далее рассчитываем Твых из реактора по уравнению Qвых расч =∑Gвых*Ср*Твых, методом последовательного приближения:
| пропан | метан | этилен | H20 | |
| Сp,Дж/моль*К | 181,7016 | 77,4196 | 97,5056 | 42,22682 |
(1:4)
| Т вых, К | Q вых расч,Дж/ч |
| 161008850,2 | |
| 182430204,2 | |
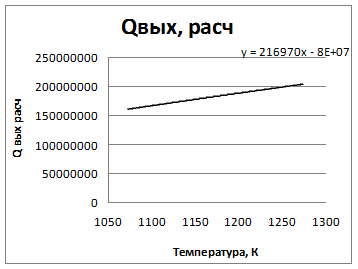
ТвыхХ= (Q'вых+b)/a= 935,6595К
∆Т= ТХ-Твх= 152,3404К
При разб.1:6
| Т вых, К | Q вых расч,Дж/ч |
| 200619480,4 | |
| 227003220,9 | |
| 254111973,3 |

ТвыхХ= 939,2190К
∆Т=148,7809 К
При 1:7 молей воды
| Т вых, К | Q вых расч,Дж/ч |
| 220424795,5 | |
| 249289729,2 | |
| 278965815,9 |

ТвыхХ= 957,6366К
∆Т= 130,3633К
При разб.1:8
| Т вых, К | Q вых расч,Дж/ч |
| 240230110,5 | |
| 271576237,6 | |
| 303819658,5 |
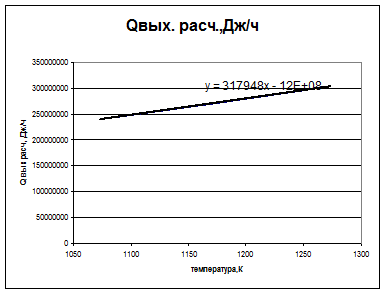
Твых Х= 1004,5825К
∆Т= 83,4174К
Влияние разбавителя на разность температур на входе и выходе, представим графиком зависимости ∆Т(n).
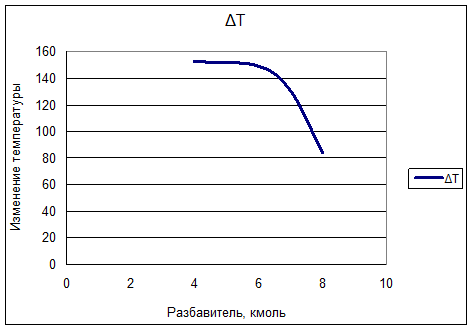
График показывает, что с увеличением количества разбавителя происходит уменьшение разности температур на входе и выходе.
|
|
|
Разбавление сырья водяным паром благотворно сказывается на процессе пиролиза. При работе с большими количествами перегретого водяного пара (до 1: 4; 1: 8) резко снижается парциальное давление и вследствие увеличивается выход этилена до 45% на пропущенный пропан при 8150С и времени контакта 0,4 сек.
Вывод: таким образом адиабатический перепад температур ∆Т=83,4174 К следовательно при данном процессе нельзя использовать адиабатический режим.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 1970; Нарушение авторских прав?; Мы поможем в написании вашей работы!