
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа
Распределение в-ва м/у 2 фазами.
Пусть имеется система, состоящ. из одного компонента и 2 фаз. Возьме жид-ть и пар, настолько разреженный, что его можно считать идеаль. газом. Тогда, подставляя выражения для хим. потен-ла для пара и жидкости, имеем:
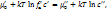 (1)
(1)
где индекс ‘ относится к жид., а ‘’ – к газообразной фазе
с – концен-ция, fa – коэф. актив-ти,
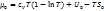
Cooт (1) можно зап-ть в след. виде
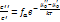 (2)
(2)
Эта фор-ла м.б. применима и для случая, когда с’ – конц. в-ва в тв. фазе, а с’’ – в р-ре, кот-ю считают идеаль-м, т.е. полагают, что в-во ведет себя в нем, как идеаль. газ.
Плавление, возгонка, аморфные превращения. Основ. хар-ка – тем-ра, кот-рая зависит от давления. Для нахождения связи м/у Т и р используем смешан-е произ-ные по переменным разных видов:

При фаз-х прев-ях р не зависит от V. Поэтому частные произ-е можно заменить полной.
При изотерм. фаз-х прев-х V меняется на ΔV, а энтропия на ΔS

Т.к. процесс фаз-го прев-я яв-ся изотермич. и равновесным, то
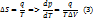
q – теплота плавления, затверд.,…
ΔV = V’’ – V’
Ур-е (3) - ур-е Клауз-са-Клапейрона
Если тем-ра значит. ниже критич. то V-ом жидкости и тв. тела можно пренебречь по сравнению с объемом пара
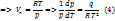


I – химич. постоянная
Поскольку фаз-й переход происх-т при постоянном давлении, то для нах-ния зависимости q(T) используют зав-ть энтальпии от тем-ры:
q = Нп – Нж
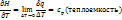

Cоот. (7) – ур-ние Кирхгофа
|
|
Дата добавления: 2015-06-04; Просмотров: 363; Нарушение авторских прав?; Мы поможем в написании вашей работы!