
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые сложные белки
Классификация белков
В организме человека содержится свыше 50 тысяч различных белков, имеющих индивидуальную первичную структуру, конформацию, строение активного центра и функции, которые различаются по молекулярной массе и химическим свойствам. Поэтому классифицировать белки очень сложно и подходов здесь много. Белки можно классифицировать: по форме (глобулярные и фибриллярные), по молекулярной массе (низко-, высокомолекулярные и др.); по химическому строению (отсутствие или наличию небелковой части), по функциям и локализации в клетке (ядерные, цитоплазматические, лизосомальные, митохондриальные и др.), по возможности регулировать синтез белков (конститутивные, синтез которых идет с постоянной скоростью и индуцибельные, синтез которых возрастает при воздействии факторов среды), по продолжительности жизни в клетке (очень быстро обновляющиеся, менее чем через час и медленно обновляющиеся в течении недель и месяцев), по схожим участкам первичной структуры и родственным функциям (семейства белков).
І. По форме молекул белки бывают глобулярные и фибриллярные.
Глобулярные белки имеют форму эллипса или сферы. К ним относят белки, соотношение продольной и поперечной осей которых составляет 1:3 или 1:4, но не превышает 1:10. Рельеф их поверхности включает выступы, впадины, щели и определяет биологические функции. При образовании конформации глобул гидрофобные радикалы аминокислот уходят внутрь глобулы, а гидрофильные остаются на поверхности глобул и поэтому они хорошо растворимы в воде. К ним относится большая часть индивидуальных белков человека: ферменты, гормоны, антитела, запасные белки, гемоглобин (рис.40).
Фибриллярные белки имеют вытянутую форму, нитевидную струк- туру; соотношение продольной и поперечной осей которых больше 1:10. Благодаря присущей этим белкам жесткости и эластичности они выполняют чаще всего опорную и структурную функции, принимают участие в сокращении мышц (миозин), свертывание крови (фибрин). Молекулы фиб -
риллярных белков образовывают нитевидные агрегаты - фибриллы.

Рис.40. Глобулярный белок гемоглобин
Самый распространенный белок в мире животных - коллаген сухожилий, костной ткани; на его долю у человека приходится 1:4 всех белков. Фибриллы коллагена обладают огромной прочностью и практически нерастяжимы. Они могут выдержать нагрузку, в 1000 раз превышающую их вес и по прочности превосходит прочность стальной проволоки такого же сечения. Молекула состоит из 3-х полипептидных цепей, каждая цепь - из 1000 аминокислотных остатков; каждая 3-я аминокислота – глицин, 20% составляет пролин. 3 спирали перекручены в плотный жгут (рис.41). Фибриллярные белки нерастворимы в воде и не перевариваются в пищеварительном тракте. К ним относятся, кроме коллагена, кератин волос, кожи, перьев, эластин соединительной ткани, фиброин шелка, миозин мыщц, фибрин крови.



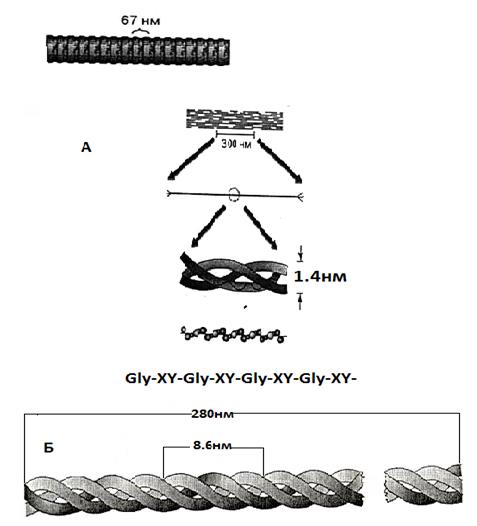

Рис.41. Организация белка коллагена: А – фибрилла диаметром 67 нм; фибрилла диаметром 300нм; тройная спираль диаметром 1.4 нм; α-спираль; аминокислотная последовательность первичной структуры полипептида; Б -коллаген,состоящий из 3 α-цепей, скрученных в правостороннюю спираль. (Из: Фаллер, Шилдс,2004)
ІІ. Помолекулярной массе белки делятся на низко- и высокомо- лекулярные, куда относятся и олигомерные белки. Молекулярная масса определяется путем умножения количества аминокислот на величину средней массы аминокислот (100), а у олигомерных белков - еще и на количество протомеров. Так, олигопептиды содержат до 10 аминокислот, полипептиды – до 50, белки - свыше 50. Соответственно молекулярная масса будет от 1000Да у олигопептидов до 5 кДа у белков.
ІІІ. По химическому строению белки делятся на простые и сложные ( табл.5).
Таблица 5
| Белки | Простетическая группа |
| Металлопротеины Фосфопротеины Гемопротеины Флавопротеины Гликопротеины Протеогликаны Липопротеины Нуклеопротеины Рибонуклеопротеины (рибосомы и др.) Дезоксирибонуклеопротеины (хроматин) | Ионы металлов Н3РО4 Гем (ферропротопорфирин) Флавиннуклеотиды (прозводственные рибофлавина В12) Моносахариды и олигосахариды Гликозаминглюканы (мукополисахариды) Триглицериды и сложные липиды РНК ДНК |
Простые белки содержат в своих полипептидных цепях только аминокислотные остатки. К ним относятся: альбумины, глобулины, проламины, глютамины, гистоны, протамины, протеноиды. К альбуминам относятся белок куриного яйца овальбумин и белок молочной сыворотки лактальбумин. Гистоны и протамины – это низкомолекулярные белки, основная функция которых структурная; обеспечивает стабилизацию молекулы ДНК. Протеноиды - это фибриллярные белки опорных тканей
(коллаген, эластин, кератин, фиброин). Остальные белки характерны для растений.
ІV. Согласно выполняемым функциям белки делятся на:
1. Ферменты – белки, катализаторы химических реакций. Скорость химических реакций возрастает в миллионы раз. Ферменты катализируют строго определенный тип химических превращений (трипсин разрушает пептидную связь, рибонуклеаза – фосфодиэфирную связь и т.д.) и обеспечивает превращения поступающих в клетку веществ в строго определенном направлении. В настоящее время известно около 200 различных ферментов.
2. Регуляторные белки - обеспечивают регуляцию и интеграцию клеточного обмена веществ, участвуя в поддержании постоянства внутренней среды организма. К ним относятся: белковые гормоны (регулируют углеводный, белковый и жировой обмены); белки, регуляторы функций других белков или структур клетки; ДНК-связывающиеся белки (регулируют скорость считывания генетической информации) и др.
3. Рецепторные белки – участвуют в передаче сигнала от сигнальных молекул (гормонов, нейромедиаторов) в клетку. Входят в состав мембран клеток-мишеней или находятся в цитоплазме и принимают участие в регуляции внутриклеточных процессов.
4. Транспортные белки – связывают и транспортируют вещества через мембраны и между тканями. К ним относятся: липопротеины, переносящие липиды через мембраны, миоглобин, переносящий кислород в мышечных тканях, гемоглобин, переносящий кислород из легких в ткани, альбумин (белок плазмы крови), транспортирующий жирные кислоты, белки-переносчики (пермеазы) глюкозы, аминокислот, ионов и других веществ через мембраны клеток.
5. Структурные белки – белки, участвующие в построении мембран клетки, придающие форму клеткам и тканям, обеспечивающие опору, определяющие механические свойства ткани. Сюда относятся коллаген, эластин, кератин и белки мембран.
6. Защитные белки – обеспечивают защиту клетки от агентов, обладающих чужеродной генетической информацией (вирусы, бактерии, чужеродные белки извне и возникшие в результате мутаций). Защитными свойствами обладают иммуноглобулины и белки свертывающей системы крови – фибриноген и тромбин. Последние участвуют в формировании тромба, которые закупоривают стенку поврежденного сосуда, предохраняя организм от потери крови.
7. Сократительные белки - обеспечивают преобразование химичес- кой энергии в механическую, наделяя клетку способностью сокращаться или передвигаться самой или отдельным ее частям. Сюда относятся белки актин, миозин, тубулин и др.
8. Резервные белки - используются клеткой как запасной материал для питания развивающихся клеток и организмов. Сюда относится прола- мин, глютемин – белки хлебных злаков, альбумин - белок яйца, исполь- зуемый для развития зародыша, казеин молока – используется для кормления новорожденных.
9 . Белки, объединяемые в семейства. В процессе эволюции в результате замены нуклеотидов возникли белки, имеющие гомологичные последовательности аминокислот и выполняющие родственные функции. Гомологичные последовательности аминокислот имеют в одном и том же положении одни и те же аминокислоты, называемые инвариантными, а в других положения разные, но близкие по физико-химическим свойствам, аминокислоты. Эти белки образуют схожие конформации, повороты и изгибы пептидной цепи. Такие белки образуют семейство родственныхбелков. К ним относятся семейство гемоглобинов (миоглобин, гемоглобин А, А2, гемоглобин F); семейство серинов, протеаз, суперсемейство иммуно- глобулинов, семейство родственных фибриллярных белков.
|
|
Дата добавления: 2015-06-04; Просмотров: 1082; Нарушение авторских прав?; Мы поможем в написании вашей работы!